北京市丰台区2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2021-01-13 类型:期中考试
一、单选题
-
1. 下列设备工作时,将化学能转化为热能的是( )
A
B
C
D




燃气灶
太阳能热水器
纽扣电池
太阳能电池
A、A B、B C、C D、D2. 能源是人类生存和发展的重要基础,下列措施对于能源的可持续发展不利的是( )A、开发新能源 B、节约现有能源 C、提高能源利用率 D、直接燃煤获取能量3. 下列说法中,正确的是( )A、固体溶解是一个熵减小的过程 B、能够自发进行的反应一定是放热反应 C、能够自发进行的反应一定是熵增加的过程 D、同一物质气态时的熵值最大,液态时的次之,固态时的最小4. 下列反应的焓变表示甲烷的摩尔燃烧焓(燃烧热)的是( )A、CH4(g)+2O2(g) =CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol B、CH4(g)+2O2(g) =CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol C、CH4(g)+ O2(g) =CO(g)+2H2O(l) ΔH=-607.3 kJ/mol D、CH4(g)+ O2(g) =CO(g)+2H2O(g) ΔH=-519.3 kJ/mol5. 已知N2(g)+3H2(g)=2NH3(g) ΔH=-92.3 kJ∙mol−1 , 则NH3(g) = N2(g)+ H2(g)的焓变为( )A、+46.1 kJ/mol B、-46.1 kJ/mol C、+ 92.3 kJ/mol D、-92.3 kJ/mol6. 已知氢气燃烧的下列3个反应:H2(g)+ O2(g) =H2O(g) ΔH1=-a kJ·mol-1
H2(g)+ O2(g) =H2O(l) ΔH2=-b kJ·mol-1
2H2(g)+O2(g) =2H2O(l) ΔH3=-c kJ·mol-1
下列关系正确的是( )
①b>a ②b<a ③2a>c ④2b=c
A、①和④ B、②和④ C、②和③ D、①和③7. N2和 H2在催化剂表面合成氨的微观历程及能量变化的示意图如图,用 、
、  、
、  分别表示N2、H2、NH3 , 已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92 kJ·mol-1 ,下列说法正确的是( )
分别表示N2、H2、NH3 , 已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92 kJ·mol-1 ,下列说法正确的是( )  A、使用催化剂导致反应过程发生变化,合成氨反应放出的热量增大 B、②→③过程,是吸热过程且只有H-H键的断裂 C、③→④过程,N原子和H原子形成NH3是能量升高的过程 D、合成氨反应中,反应物断键吸收的能量小于生成物形成新键释放的能量8. 一个化学反应无论是一步完成还是分几步完成,反应热都是一样的。该定律称为盖斯定律。依据图示关系,下列说法错误的是( )
A、使用催化剂导致反应过程发生变化,合成氨反应放出的热量增大 B、②→③过程,是吸热过程且只有H-H键的断裂 C、③→④过程,N原子和H原子形成NH3是能量升高的过程 D、合成氨反应中,反应物断键吸收的能量小于生成物形成新键释放的能量8. 一个化学反应无论是一步完成还是分几步完成,反应热都是一样的。该定律称为盖斯定律。依据图示关系,下列说法错误的是( ) A、石墨燃烧是放热反应 B、1 mol C(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2 , 后者放热多 C、C(石墨) + O2(g) = CO(g) ΔH=ΔH1-ΔH2 D、化学反应的ΔH , 只与反应体系的始态和终态有关,与反应途径无关9. 下列有关电池的说法错误的是( )A、电池是将化学能转化为电能的装置 B、化学电源的反应基础是氧化还原反应 C、手机上用的锂离子电池属于二次电池 D、电池到达寿命无法使用时可随意丢弃10. 下列关于电解的说法错误的是( )A、电解是将电能转化为化学能的过程 B、电解池的阳极与电源的正极相连,发生氧化反应 C、电解时,电子由电源负极流向阴极,通过电解质溶液到达阳极 D、许多在通常条件下不能发生的氧化还原反应,可以通过电解实现11. 下列说法中,错误的是( )A、生铁比纯铁更易生锈 B、钢柱在水下的部分比在空气与水的交界处更易生锈 C、用锡焊接铁质器件,焊接处铁易生锈 D、生铁在湿润环境中比在干燥环境中更易生锈12. 四块相同的锌片分别放置在下列四个装置中(烧杯中均盛有0.1 mol·L-1 NaCl溶液),则锌片腐蚀最快的是( )A、
A、石墨燃烧是放热反应 B、1 mol C(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2 , 后者放热多 C、C(石墨) + O2(g) = CO(g) ΔH=ΔH1-ΔH2 D、化学反应的ΔH , 只与反应体系的始态和终态有关,与反应途径无关9. 下列有关电池的说法错误的是( )A、电池是将化学能转化为电能的装置 B、化学电源的反应基础是氧化还原反应 C、手机上用的锂离子电池属于二次电池 D、电池到达寿命无法使用时可随意丢弃10. 下列关于电解的说法错误的是( )A、电解是将电能转化为化学能的过程 B、电解池的阳极与电源的正极相连,发生氧化反应 C、电解时,电子由电源负极流向阴极,通过电解质溶液到达阳极 D、许多在通常条件下不能发生的氧化还原反应,可以通过电解实现11. 下列说法中,错误的是( )A、生铁比纯铁更易生锈 B、钢柱在水下的部分比在空气与水的交界处更易生锈 C、用锡焊接铁质器件,焊接处铁易生锈 D、生铁在湿润环境中比在干燥环境中更易生锈12. 四块相同的锌片分别放置在下列四个装置中(烧杯中均盛有0.1 mol·L-1 NaCl溶液),则锌片腐蚀最快的是( )A、 B、
B、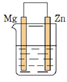 C、
C、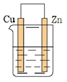 D、
D、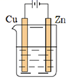 13. 海港、码头的钢制管桩会受到海水的长期侵蚀,常用外加电流法对其进行保护,如图所示,其中高硅铸铁为惰性辅助阳极。下列说法错误的是( )
13. 海港、码头的钢制管桩会受到海水的长期侵蚀,常用外加电流法对其进行保护,如图所示,其中高硅铸铁为惰性辅助阳极。下列说法错误的是( ) A、钢制管桩应与电源的负极相连 B、通电后外电路的电子被强制流向钢制管桩 C、高硅铸铁及钢制管桩周边没有电极反应发生 D、保护电流应该根据环境条件变化进行调整14. 测定中和反应的反应热的装置如图所示,下列有关该实验的说法中错误的是( )
A、钢制管桩应与电源的负极相连 B、通电后外电路的电子被强制流向钢制管桩 C、高硅铸铁及钢制管桩周边没有电极反应发生 D、保护电流应该根据环境条件变化进行调整14. 测定中和反应的反应热的装置如图所示,下列有关该实验的说法中错误的是( ) A、测定中和反应的反应热时,不能选用NaOH溶液和浓硫酸 B、相同条件下,NaOH溶液与盐酸、硝酸反应的反应热不相同 C、实验需要记录反应前初始温度及反应后溶液达到的最高温度 D、环形玻璃搅拌棒上下搅拌有助于反应充分,泡沫塑料起保温作用15. 下列关于电解CuCl2 溶液(如图所示)的说法中,错误的是( )
A、测定中和反应的反应热时,不能选用NaOH溶液和浓硫酸 B、相同条件下,NaOH溶液与盐酸、硝酸反应的反应热不相同 C、实验需要记录反应前初始温度及反应后溶液达到的最高温度 D、环形玻璃搅拌棒上下搅拌有助于反应充分,泡沫塑料起保温作用15. 下列关于电解CuCl2 溶液(如图所示)的说法中,错误的是( ) A、阴极石墨棒上有红色的铜附着 B、阳极电极反应为:2Cl--2e-=Cl2 C、电解过程中,Cl-和OH-向阳极移动 D、总反应为:CuCl2=Cu2++2Cl-16. 若要在铁钉上镀铜,下列设计正确的是( )
A、阴极石墨棒上有红色的铜附着 B、阳极电极反应为:2Cl--2e-=Cl2 C、电解过程中,Cl-和OH-向阳极移动 D、总反应为:CuCl2=Cu2++2Cl-16. 若要在铁钉上镀铜,下列设计正确的是( )选项
接电源正极
接电源负极
电解质溶液
A
Cu
Fe
CuSO4溶液
B
Cu
Fe
FeSO4溶液
C
Fe
Cu
CuSO4溶液
D
Fe
Cu
FeSO4溶液
A、A B、B C、C D、D17. 粗铜中含有锌、铁、金、银等杂质,通过电解法将其精炼,下列说法错误的是( )A、粗铜与电源的正极相连发生氧化反应:Cu-2e-= Cu2+ B、精铜作为阴极材料,不参与电极反应,电解过程中逐渐变粗 C、用CuSO4作电解质溶液,电解过程中CuSO4溶液浓度略减小 D、锌、铁、金、银等杂质沉积在阳极周围,成为阳极泥18. 碱性锌锰电池以氢氧化钾溶液为电解质溶液,其结构示意图如图所示,电池总反应式为:Zn + 2MnO2 + 2H2O=Zn(OH)2 + 2MnOOH。下列说法中错误的是( ) A、电池工作时,电子转移方向是由Zn经外电路流向MnO2 B、电池正极反应式为2MnO2 + 2H2O + 2e-=2MnOOH + 2OH- C、电池工作时,KOH不参与反应,没有发挥作用 D、电池工作时,Zn发生氧化反应,MnO2发生还原反应19. 铅蓄电池的结构示意图如图所示,其充、放电时的电池反应为: Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O。下列说法正确的是( )
A、电池工作时,电子转移方向是由Zn经外电路流向MnO2 B、电池正极反应式为2MnO2 + 2H2O + 2e-=2MnOOH + 2OH- C、电池工作时,KOH不参与反应,没有发挥作用 D、电池工作时,Zn发生氧化反应,MnO2发生还原反应19. 铅蓄电池的结构示意图如图所示,其充、放电时的电池反应为: Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O。下列说法正确的是( ) A、放电时Pb为负极,发生反应:Pb-2e-= Pb2+ B、放电时H+向正极移动,正极区域酸性增强 C、充电时PbO2与外电源的负极相连 D、充电时阳极发生反应:PbSO4-2e-+2H2O = PbO2+SO +4H+20. 热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水 LiCl−KCl 混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为:PbSO4 + 2LiCl + Ca = CaCl2 + Li2SO4 + Pb。关于该电池的下列说法中,错误的是( )
A、放电时Pb为负极,发生反应:Pb-2e-= Pb2+ B、放电时H+向正极移动,正极区域酸性增强 C、充电时PbO2与外电源的负极相连 D、充电时阳极发生反应:PbSO4-2e-+2H2O = PbO2+SO +4H+20. 热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水 LiCl−KCl 混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为:PbSO4 + 2LiCl + Ca = CaCl2 + Li2SO4 + Pb。关于该电池的下列说法中,错误的是( ) A、负极的电极反应:Ca−2e- = Ca2+ B、放电时,K+向硫酸铅电极移动 C、硫酸铅作正极材料,LiCl为正极反应物 D、常温时,在正负极之间连上检流计,指针不偏转21. 以石墨作电极,电解AgNO3溶液,可在两极分别得到Ag和O2 , 下列说法正确的是( )A、氧化性:Ag+ > H+ , 还原性:NO > OH- B、Ag附着在阳极:Ag+ + e-=Ag C、电解过程中溶液的酸性将逐渐减弱 D、电路中每转移1mol电子,可生成1molAg和0.25molO2
A、负极的电极反应:Ca−2e- = Ca2+ B、放电时,K+向硫酸铅电极移动 C、硫酸铅作正极材料,LiCl为正极反应物 D、常温时,在正负极之间连上检流计,指针不偏转21. 以石墨作电极,电解AgNO3溶液,可在两极分别得到Ag和O2 , 下列说法正确的是( )A、氧化性:Ag+ > H+ , 还原性:NO > OH- B、Ag附着在阳极:Ag+ + e-=Ag C、电解过程中溶液的酸性将逐渐减弱 D、电路中每转移1mol电子,可生成1molAg和0.25molO2二、填空题
-
22. 25 ℃和101 kPa下,H2(g)+Cl2(g) =2HCl(g) 能量变化如图,根据图示回答下列问题:
 (1)、结合图示,说明431kJ·mol-1表示的含义是。(2)、H2(g)+Cl2(g) = 2HCl(g) 的焓变ΔH =。23. 金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1)、结合图示,说明431kJ·mol-1表示的含义是。(2)、H2(g)+Cl2(g) = 2HCl(g) 的焓变ΔH =。23. 金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题: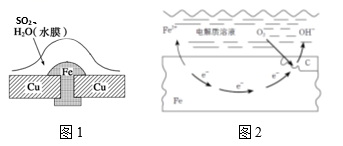 (1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。
(1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)、图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理。(3)、图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 , 负极反应为 , 总反应为。(4)、下列防止铁制品生锈的措施合理的是__________。A、在铁闸门表面涂油漆 B、在地下铁管道上安装若干镁合金 C、将铁罐与浓硫酸等强氧化剂接触,使之发生钝化24. 目前煤在我国依然是第一能源,煤的气化可以实现煤的综合利用,提高煤的利用价值。已知:煤气化反应为C(s) + H2O(g) = CO(g)+H2(g) ΔH
① C(s)+O2(g) = CO2(g) ΔH1=-393.5 kJ/mol
② CO(g)+ O2(g) = CO2(g) ΔH2=-283.0 kJ/mol
③ H2(g)+ O2(g) = H2O(g) ΔH3=-242.0 kJ/mol
(1)、ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH = ;ΔH = kJ/mol。(2)、从两个不同的角度评价将煤转化为CO和H2再燃烧的优点是。25. 实验室用石墨电极电解加有酚酞的饱和NaCl溶液,装置如图1所示。氯碱工业用图2所示装置制备NaOH等工业原料。 (1)、Ⅰ.实验室电解饱和食盐水(图1)
(1)、Ⅰ.实验室电解饱和食盐水(图1)a为电解池的极,a处的电极反应式为。
(2)、b处的电极反应式为 , 观察到的实验现象是。(3)、该电解池中发生的总反应的离子方程式为。(4)、下列与电解饱和食盐水有关的说法,正确的是___________(填字母)。A、通电使NaCl发生电离 B、在溶液中,阴离子向电极a移动 C、电解熔融NaCl与电解NaCl溶液所得产物相同(5)、Ⅱ.氯碱工业(图2)利用实验室装置制备NaOH,不仅有安全隐患,而且存在Cl2与NaOH的副反应,氯碱工业采用改进后的装置,如图2所示。
① 气体X和气体Y被阳离子交换膜分隔开,避免混合爆炸。气体X是 , 气体Y是。
②阳离子交换膜避免了Cl2与NaOH发生反应,可得到NaOH浓溶液,简述NaOH浓溶液的生成过程。
26. 电镀行业产生的酸性含铬废水对环境有污染,其中所含的+6价铬(以Cr2O 形式存在)是主要污染物,可采用电解法将其除去。向酸性含铬废水中加入适量NaCl固体,以Fe为阴、阳电极进行电解。经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,从而使废水中铬含量低于排放标准。装置如图所示。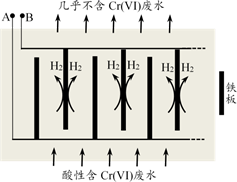
已知:pH=3.2时Fe3+完全转化为Fe(OH)3;pH=5.6时Cr3+完全转化为Cr(OH)3
(1)、向酸性含铬废水中加入适量NaCl固体的作用是。(2)、B极上有大量氢气产生,电极反应为。(3)、结合化学用语分析酸性废水中Cr2O 转化为Cr(OH)3的主要原因。三、原理综合题
-
27. 甲醇(CH3OH)在作为内燃机燃料、制作燃料电池等方面具有重要的用途。(1)、25℃、101 kPa时,1 mol甲醇完全燃烧生成液态水释放的能量是762.5 kJ,写出该反应的热化学方程式。(2)、64 g甲醇完全燃烧生成液态水释放的热量为kJ。(3)、工业上以CO2和H2为原料合成甲醇:CO2(g) + 3H2(g) = CH3OH(g)+H2O(l) ΔH= a kJ/mol,若要计算a,需要知道甲醇完全燃烧生成液态水的焓变以及的焓变(文字描述)。(4)、甲醇的另一种用途是制成燃料电池,装置图如图所示。采用铂作为电极材料,稀硫酸作电解质溶液,向其中一个电极直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:

①电池的正极反应式为: , 负极反应式为:。
②该电池工作时,H+的移动方向是由极经质子交换膜流向极(填“a”或“b”)。
③ 甲醇可作为内燃机燃料,也可用于制作燃料电池,其反应均为甲醇与氧气的反应,但能量转化形式不同,电池将化学能转化为电能的根本原因是。
28. 如图为铜锌原电池的装置示意图,其中盐桥内装琼脂-饱和KCl溶液。请回答下列问题: (1)、Zn电极为电池的(填“正极”或“负极”)。(2)、写出电极反应式:Zn电极: Cu电极:。(3)、盐桥中向CuSO4溶液中迁移的离子是。(4)、若保持原电池的总反应不变,下列替换不可行的是____________(填字母)。A、用石墨替换Cu电极 B、用NaCl溶液替换ZnSO4溶液 C、用稀H2SO4代替CuSO4溶液(5)、请选择适当的材料和试剂,将反应2Fe3+ + 2I-= 2Fe2+ + I2设计成一个原电池,请填写表格:
(1)、Zn电极为电池的(填“正极”或“负极”)。(2)、写出电极反应式:Zn电极: Cu电极:。(3)、盐桥中向CuSO4溶液中迁移的离子是。(4)、若保持原电池的总反应不变,下列替换不可行的是____________(填字母)。A、用石墨替换Cu电极 B、用NaCl溶液替换ZnSO4溶液 C、用稀H2SO4代替CuSO4溶液(5)、请选择适当的材料和试剂,将反应2Fe3+ + 2I-= 2Fe2+ + I2设计成一个原电池,请填写表格:设计思路
负极
负极材料
负极反应物
正极
正极材料
正极反应物
电子导体
离子导体
在方框内画出简单的装置示意图,并标明使用的材料和试剂。
