2016年江苏省苏州市中考化学试卷
试卷更新日期:2016-07-05 类型:中考真卷
一、选择题(共25小题,每小题2分,满分50分)
-
1.
2016年“世界环境日”中国确定的主题为“改善环境质量,推动绿色发展”.下列做法与之相违背的是( )
 A、农作物的秸杆就地焚烧 B、社会公共场所严禁吸烟 C、积极开展绿化国土行动 D、工业废水处理达标后排放2. 下列化学用语中,既能表示一种元素,又能表示一种物质的是( )A、H2 B、Cu C、CO2 D、HCl3. 下列属于物理变化的是( )A、甘薯酿酒 B、石蜡熔化 C、烟花爆炸 D、食物腐败4. 下列物质属于混合物的是( )A、氧气 B、氧化铜 C、硫酸钠 D、空气5. 下列物质化学式书写正确的是( )A、铝:AL B、氯化钾:KCl2 C、硫酸铜:CuSO4 D、四氧化三铁:O4Fe36. 过滤时不需要的仪器是( )A、
A、农作物的秸杆就地焚烧 B、社会公共场所严禁吸烟 C、积极开展绿化国土行动 D、工业废水处理达标后排放2. 下列化学用语中,既能表示一种元素,又能表示一种物质的是( )A、H2 B、Cu C、CO2 D、HCl3. 下列属于物理变化的是( )A、甘薯酿酒 B、石蜡熔化 C、烟花爆炸 D、食物腐败4. 下列物质属于混合物的是( )A、氧气 B、氧化铜 C、硫酸钠 D、空气5. 下列物质化学式书写正确的是( )A、铝:AL B、氯化钾:KCl2 C、硫酸铜:CuSO4 D、四氧化三铁:O4Fe36. 过滤时不需要的仪器是( )A、 玻璃棒
B、
玻璃棒
B、 漏斗
C、
漏斗
C、 烧杯
D、
烧杯
D、 燃烧匙
7. 下列人体所缺元素与引起的健康问题关系不正确的是( )A、缺钙会引起骨质疏松 B、缺碘会引起甲状腺疾病 C、缺铁会引起龋齿 D、缺锌会导致儿童智力低下8.
燃烧匙
7. 下列人体所缺元素与引起的健康问题关系不正确的是( )A、缺钙会引起骨质疏松 B、缺碘会引起甲状腺疾病 C、缺铁会引起龋齿 D、缺锌会导致儿童智力低下8.硝酸银受热时会发生如下反应:2AgNO3
 2Ag+2X↑+O2↑.根据质量守恒定律,推测X是( )A、N2O B、NO2 C、N2O5 D、NO9. 铬酸钾(K2CrO4)是印染、医药、电焊、搪瓷等工业的原料.铬酸钾中铬元素(Cr)的化合价为( )A、+3 B、+4 C、+5 D、+610. 下列实验操作正确的是( )A、
2Ag+2X↑+O2↑.根据质量守恒定律,推测X是( )A、N2O B、NO2 C、N2O5 D、NO9. 铬酸钾(K2CrO4)是印染、医药、电焊、搪瓷等工业的原料.铬酸钾中铬元素(Cr)的化合价为( )A、+3 B、+4 C、+5 D、+610. 下列实验操作正确的是( )A、 取下刚加热后的蒸发皿
B、
取下刚加热后的蒸发皿
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 熄灭酒精灯
D、
熄灭酒精灯
D、 向上排空气法收集二氧化碳
11. 下列属于合成材料的是( )A、陶瓷 B、塑料 C、羊毛 D、木材12. 下列关于氧气的说法正确的是( )A、液态氧可用作火箭的助燃剂 B、氧气在空气中的体积分数为78% C、硫在氧气中燃烧发出黄色火焰 D、鱼类能在水中生存,证明氧气易溶于水13. 下列关于二氧化碳的说法不正确的是( )A、二氧化碳有毒 B、二氧化碳常用于灭火 C、干冰可用于人工降雨 D、光合作用会消耗二氧化碳14. 水是生命之源.下列关于水的说法不正确的是( )A、水由液态变成气态时,分子间空隙变大 B、电解水生成氢气和氧气,说明水是由氢气和氧气组成 C、活性炭具有吸附性,可用于除去水中的异味 D、如果将水样蒸干后有固体析出,这种水样中一定含有杂质15. 下列说法正确的是( )A、所有金属都呈银白色 B、铁制品在潮湿的空气中不易生锈 C、铁是地壳中含量最高的金属元素 D、工业炼铁的主要原理是用一氧化碳与铁矿石在高温下反应生成铁16.
向上排空气法收集二氧化碳
11. 下列属于合成材料的是( )A、陶瓷 B、塑料 C、羊毛 D、木材12. 下列关于氧气的说法正确的是( )A、液态氧可用作火箭的助燃剂 B、氧气在空气中的体积分数为78% C、硫在氧气中燃烧发出黄色火焰 D、鱼类能在水中生存,证明氧气易溶于水13. 下列关于二氧化碳的说法不正确的是( )A、二氧化碳有毒 B、二氧化碳常用于灭火 C、干冰可用于人工降雨 D、光合作用会消耗二氧化碳14. 水是生命之源.下列关于水的说法不正确的是( )A、水由液态变成气态时,分子间空隙变大 B、电解水生成氢气和氧气,说明水是由氢气和氧气组成 C、活性炭具有吸附性,可用于除去水中的异味 D、如果将水样蒸干后有固体析出,这种水样中一定含有杂质15. 下列说法正确的是( )A、所有金属都呈银白色 B、铁制品在潮湿的空气中不易生锈 C、铁是地壳中含量最高的金属元素 D、工业炼铁的主要原理是用一氧化碳与铁矿石在高温下反应生成铁16.根据如图甲、乙、丙三种物质的转化关系,推测丙可能为( )
 A、碳酸钙 B、氧化钙 C、氢氧化钙 D、碳酸钠17. 下列说法不正确的是( )A、葡萄糖是有机高分子化合物 B、蛋白质受强热会失去原有的生理功能 C、油脂是人体必需的营养物质 D、人误食重金属盐中毒后服用蛋清可减轻毒性18. 下列关于溶液的说法正确的是( )A、食用油加入水中,振荡后可形成溶液 B、氢氧化钠固体溶于水时吸收热量,溶液温度降低 C、稀硫酸能够导电,因为溶液中有较多自由移动的离子 D、硝酸钾饱和溶液中加少量氯化钠固体,固体不溶解19. 鉴别下列各组物质,不能达到目的是( )A、氧气与二氧化碳:带火星的木条 B、面粉与玉米粉:碘水 C、铜绿与二氧化锰:看颜色 D、酒精与白醋:闻气味20. 苏州东山白沙枇杷是中国“十大”枇杷品牌之一.枇杷中富含的维生素A1;具有预防夜盲症、抗衰老和促进骨骼生长等功效,其化学式为C20H30O.下列说法正确的是( )A、维生素A1的相对分子质量为286g B、维生素A1是由20个碳元素、30个氢元素和1个氧元素组成 C、维生素A1中碳元素的质量分数最大 D、维生素A1中碳元素,氢元素、氧元素的质量比为20:30:121. 下列各组离子在溶液中能大量共存的是( )A、H+、SO42﹣、OH﹣ B、H+、Cl﹣、CO32﹣ C、Cu2+、Cl﹣、OH﹣ D、Na+、NO3﹣、SO42﹣22. 除去下列物质中所含的少量杂质(括号内的为杂质),所用试剂及主要实验操作均正确的一组是( )
A、碳酸钙 B、氧化钙 C、氢氧化钙 D、碳酸钠17. 下列说法不正确的是( )A、葡萄糖是有机高分子化合物 B、蛋白质受强热会失去原有的生理功能 C、油脂是人体必需的营养物质 D、人误食重金属盐中毒后服用蛋清可减轻毒性18. 下列关于溶液的说法正确的是( )A、食用油加入水中,振荡后可形成溶液 B、氢氧化钠固体溶于水时吸收热量,溶液温度降低 C、稀硫酸能够导电,因为溶液中有较多自由移动的离子 D、硝酸钾饱和溶液中加少量氯化钠固体,固体不溶解19. 鉴别下列各组物质,不能达到目的是( )A、氧气与二氧化碳:带火星的木条 B、面粉与玉米粉:碘水 C、铜绿与二氧化锰:看颜色 D、酒精与白醋:闻气味20. 苏州东山白沙枇杷是中国“十大”枇杷品牌之一.枇杷中富含的维生素A1;具有预防夜盲症、抗衰老和促进骨骼生长等功效,其化学式为C20H30O.下列说法正确的是( )A、维生素A1的相对分子质量为286g B、维生素A1是由20个碳元素、30个氢元素和1个氧元素组成 C、维生素A1中碳元素的质量分数最大 D、维生素A1中碳元素,氢元素、氧元素的质量比为20:30:121. 下列各组离子在溶液中能大量共存的是( )A、H+、SO42﹣、OH﹣ B、H+、Cl﹣、CO32﹣ C、Cu2+、Cl﹣、OH﹣ D、Na+、NO3﹣、SO42﹣22. 除去下列物质中所含的少量杂质(括号内的为杂质),所用试剂及主要实验操作均正确的一组是( )项目
物质
所用试剂及主要实验操作
A
CO(CO2)
通过装有足量NaOH溶液的洗气瓶后,干燥
B
Fe 粉(Cu粉)
加入足量的稀盐酸,充分反应后,过滤、洗涤、干燥
C
NaCl溶液(CaCl2)
加入适量K2CO3溶液,充分后,过滤、蒸发、结晶
D
NH4HCO3固体(NaCl固体)
充分加热
A、A B、B C、C D、D23.如图为甲、乙两物质的溶解度曲线,下列说法正确的是( )
 A、甲、乙两物质均属于难溶物质 B、甲物质的溶解度大于乙物质的溶解度 C、t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等 D、t2℃时,甲物质饱和溶液的溶质质量分数为50%24. 分析和推理是化学学习中常用的思维方法.下列因果关系完全正确的一组是( )A、洗洁精能够洗去餐具上的油污,是因为洗洁精能够溶解油污 B、饱和澄清石灰水受热后变浑浊,是因为氢氧化钙的溶解度随温度升高而增大 C、碳酸钠溶液能使无色酚酞试液变红,是因为碳酸钠属于碱类物质 D、氯化铵与草木灰不能混合施用,是因为铵态氮肥与碱性物质混合产生氨气,降低肥效25. 控制变量是化学实验中常用的一种研究方法.下列实验方案设计不合理的是( )A、用两个相同型号的塑料瓶各收集一瓶氧气和二氧化碳,再分别注入等量的水,旋紧瓶盖,振荡,通过观察塑料瓶变瘪的程度,比较氧气和二氧化碳在水中溶解度性的强弱 B、用等体积等质量分数的双氧水和不同质量的二氧化锰混合,测定收集相同体积氧气所需要的时间,探究催化剂用量对反应速率的影响 C、取等体积不同地区的两种天然水,分别加入不同体积的同种肥皂水,振荡.观察产生泡沫的多少,比较两种天然水中Ca2+、Mg2+含量的高低 D、在相同规格的烧杯中分别加入等体积的热水和冷水,分别在其中加一滴红墨水,比较红墨水在水中的扩散速率,探究温度对分子运动速率的影响
A、甲、乙两物质均属于难溶物质 B、甲物质的溶解度大于乙物质的溶解度 C、t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等 D、t2℃时,甲物质饱和溶液的溶质质量分数为50%24. 分析和推理是化学学习中常用的思维方法.下列因果关系完全正确的一组是( )A、洗洁精能够洗去餐具上的油污,是因为洗洁精能够溶解油污 B、饱和澄清石灰水受热后变浑浊,是因为氢氧化钙的溶解度随温度升高而增大 C、碳酸钠溶液能使无色酚酞试液变红,是因为碳酸钠属于碱类物质 D、氯化铵与草木灰不能混合施用,是因为铵态氮肥与碱性物质混合产生氨气,降低肥效25. 控制变量是化学实验中常用的一种研究方法.下列实验方案设计不合理的是( )A、用两个相同型号的塑料瓶各收集一瓶氧气和二氧化碳,再分别注入等量的水,旋紧瓶盖,振荡,通过观察塑料瓶变瘪的程度,比较氧气和二氧化碳在水中溶解度性的强弱 B、用等体积等质量分数的双氧水和不同质量的二氧化锰混合,测定收集相同体积氧气所需要的时间,探究催化剂用量对反应速率的影响 C、取等体积不同地区的两种天然水,分别加入不同体积的同种肥皂水,振荡.观察产生泡沫的多少,比较两种天然水中Ca2+、Mg2+含量的高低 D、在相同规格的烧杯中分别加入等体积的热水和冷水,分别在其中加一滴红墨水,比较红墨水在水中的扩散速率,探究温度对分子运动速率的影响二、非选择题(共7小题,满分50分)
-
26. 物质的性质决定用途,请将下列物质的性质与用途对应起来.
物质的性质
A.氮气化学性质稳定 B.铜具有良好的导电性 C.浓硫酸具有吸水性 D.酒精具有可燃性 .E. 熟石灰具有碱性
物质的用途
a.保护气 b.干燥剂 c.电缆 d.改良酸性土壤 e.燃料
ABCDE
27. 写出下列反应的化学方程式.(1)、镁条在空气中燃烧生成所化镁:;(2)、锌和稀硫酸反应:;(3)、氢氧化钠溶液和稀盐酸反应:;(4)、实验室加热高锰酸钾制取氧气:;(5)、硫化氢(H2S)气体和二氧化硫气体混合生成硫和水: .28. 化学与人类的生活息息相关.请回答下列问题:(1)、日常生活和工农业生产中消耗的化石燃料主要是指煤、和天然气.天然气的主要成分是(填化学式).(2)、天然降水中会溶解部分空气里的二氧化碳气体.因此正常雨水的pH7(选填“>”或“=”或“<”).(3)、端午节吃粽子是苏州地区的一项传统民俗.制作粽子的原料有:糯米、瘦肉、食盐等.上述原料的主要成分不属于有机化合物的是 .(4)、在蒸馒头和炸油条时,下列物质既可以除去发酵过程中产生的酸,又能起发泡作用的是 (填序号).①氢氧化钠 ②碳酸氢钠.
29. “配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一.请回答下列问题:(1)、现欲配制一瓶500g溶质质量分数为0.9%的生理盐水,需氯化钠固体g.下列实验操作与目的分析均正确的一组是(填序号).项目
实验操作
目的分析
A
称量时,将取出的过量氯化钠放回原瓶
节约药品
B
溶解氯化钠时用玻璃棒搅拌
增大氯化钠的溶解度
C
称取氯化钠时,在天平两边托盘上各放一张质量相等的纸
整洁美观
D
最取所需水量时,视线与量筒内液体凹液面的最低处保持水平
准确读数
(2)、实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,此时需要用到的玻璃仪器有:烧杯、玻璃棒、量筒和 .(3)、实验室若用恒温蒸发的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示.与丙烧杯中溶液溶质质量分数一定相同的是烧杯中的溶液(填序号).
 30.
30.某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案,实现废物综合利用.部分实验流程如下:

请根据上述实验流程回答下列问题:
(1)、操作1的名称是 .(2)、在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为 , .(3)、加过量铁粉后,发生反应的基本反应类型是 , 得到滤渣1的成分为(填化学式).(4)、在实验过程中,双氧水会与Fe2+反应生成Fe3+和水,以便在后续的操作中将溶液中铁元素除去.高锰酸钾溶液也能将Fe2+氧化成Fe3+ , 选用双氧水的优点是 .31.图一是探究白磷在水中燃烧的实验装置.该装置的不足之处有:①通过氧气时,白磷易被冲散而较难与氧气接触;②逸散的五氧化二磷会造成空气污染.图二是探究白磷在水中燃烧的改进实验装置,由A、B、C三部分组成.请认真阅读下列内容并回答有关问题:

资料卡:凡能与碱反应生成盐和水的氧化物,称为酸性氧化物.常见的酸性氧化物有CO2、SO2、SiO2、P2O5等.
(1)、在仪器①中加入1药匙二氧化锰,用注射器吸入约40mL5%的过氧化氢溶液,然后将注射器的针头刺入橡皮塞中.仪器①的名称为 .(2)、在广口瓶中加入氢氧化钠溶液至其中上部,旋紧双孔塞.加入氢氧化钠溶液的目的是 .(3)、取一专人绿豆大小的白磷放入小试管中,再加入少量约80℃热水(热水的高度以小试管高度为宜);将大试管必须要小,其原因是 .
(4)、缓慢推动注射器.仪器①中发生反应的化学方程式为 , 装置B小试管中观察到的现象为:①有气泡产生;② .32.为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2 , 与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
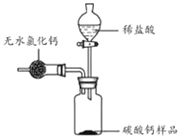
①按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
②在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57g;
③旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
④反应结束后,称得装置及装置内所有物质的总质量为570.57g
请根据上述实验回答下列问题:
(1)、该方案测得样品中碳酸钙的质量分数是多少(写出解题过程,计算结果精确到0.1%)?(2)、该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是 . 若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比(选填“偏小”或“不变”或“偏大”).