2016年福建省泉州市中考化学试卷
试卷更新日期:2016-07-05 类型:中考真卷
一、选择题(共12小题,每小题2分,满分30分)
-
1. 下列说法能减少环境污染的是( )A、燃放烟花爆竹 B、大力发展煤炭火力发电 C、垃圾分类处理 D、生活污水直接排入河流2. 下列实验基本操作错误的是( )A、
 检查装置气密性
B、
检查装置气密性
B、 点燃酒精灯
C、
点燃酒精灯
C、 滴加液体
D、
滴加液体
D、 过滤
3. 下列做法不利于身体健康的是( )A、用氮气作食品保护气 B、用铁锅做炊具烹调食物 C、用加碘食盐做调味品 D、用甲醛溶液保鲜大白菜4. 下列物质中,氯元素的化合价最高的是( )A、ClO2 B、HClO C、NaCl D、Cl25. 石墨烯是由碳元素组成的非常优良的纳米材料,具有超强导电、导热的性能.关于石墨烯的认识错误的是( )A、可作散热材料 B、是一种化合物 C、可做新型电池的电极 D、完全燃烧生成二氧化碳6. 中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是( )A、用熟石灰改良酸性土壤 B、用含氢氧化镁的药物治疗胃酸过多 C、用盐酸除去铁锈 D、用氨水(NH3•H2O)处理工厂的硫酸7. 下列化学用语书写正确的是( )A、1个镁离子:Mg+2 B、2个氮分子:2N2 C、4个氢原子:2H2 D、硫化锌:Zn2S8.
过滤
3. 下列做法不利于身体健康的是( )A、用氮气作食品保护气 B、用铁锅做炊具烹调食物 C、用加碘食盐做调味品 D、用甲醛溶液保鲜大白菜4. 下列物质中,氯元素的化合价最高的是( )A、ClO2 B、HClO C、NaCl D、Cl25. 石墨烯是由碳元素组成的非常优良的纳米材料,具有超强导电、导热的性能.关于石墨烯的认识错误的是( )A、可作散热材料 B、是一种化合物 C、可做新型电池的电极 D、完全燃烧生成二氧化碳6. 中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是( )A、用熟石灰改良酸性土壤 B、用含氢氧化镁的药物治疗胃酸过多 C、用盐酸除去铁锈 D、用氨水(NH3•H2O)处理工厂的硫酸7. 下列化学用语书写正确的是( )A、1个镁离子:Mg+2 B、2个氮分子:2N2 C、4个氢原子:2H2 D、硫化锌:Zn2S8.如图是某化学反应的微观示意图,从中获得的信息不正确的是( )
 A、该反应是化合反应 B、反应前后原子的种类、个数都不变 C、甲和丙两种物质的质量比为11:4 D、甲乙丙三种物质的分子数比为1:1:19. 如图所示的4个实验,根据现象得出的结论不正确的是( )
A、该反应是化合反应 B、反应前后原子的种类、个数都不变 C、甲和丙两种物质的质量比为11:4 D、甲乙丙三种物质的分子数比为1:1:19. 如图所示的4个实验,根据现象得出的结论不正确的是( )
A、 白磷燃烧,红磷不燃烧,说明白磷的着火点比红磷的着火点低
B、
白磷燃烧,红磷不燃烧,说明白磷的着火点比红磷的着火点低
B、 烧杯b中的酚酞溶液变红色,说明分子不断运动
C、
烧杯b中的酚酞溶液变红色,说明分子不断运动
C、 甲试管的铁钉生锈,乙试管的铁钉不生锈,说明只需与水接触铁钉就会生锈
D、
甲试管的铁钉生锈,乙试管的铁钉不生锈,说明只需与水接触铁钉就会生锈
D、 下层蜡烛先熄灭,说明通常状况下二氧化碳不能燃烧,不支持燃烧,且密度大于空气
10. 艾草中含有的黄酮素(C15H10O2)有很高的药用价值,关于黄酮素的说法正确的是( )A、是一种有机化合物 B、氧元素的质量分数为9.0% C、由27个原子构成 D、碳、氢、氧三种元素的质量比为15:10:211.
下层蜡烛先熄灭,说明通常状况下二氧化碳不能燃烧,不支持燃烧,且密度大于空气
10. 艾草中含有的黄酮素(C15H10O2)有很高的药用价值,关于黄酮素的说法正确的是( )A、是一种有机化合物 B、氧元素的质量分数为9.0% C、由27个原子构成 D、碳、氢、氧三种元素的质量比为15:10:211.如图是硝酸钾的溶解度曲线,下列说法错误的是( )
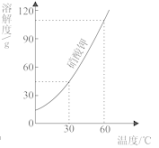 A、硝酸钾的溶解度随温度的升高而增大 B、降低温度可以使接近饱和的硝酸钾溶液变饱和 C、60℃时120g硝酸钾与100g水充分混合可以形成饱和溶液 D、60℃时硝酸钾溶液的溶质质量分数一定大于30℃时硝酸钾溶液的溶质质量分数12. 下列解释不合理的是( )A、生铁和钢的性能不同于它们的组成中含碳量不同有关 B、铁丝在空气中不能被点燃与空气中氧气的体积分数有关 C、氢氧化钠和氢氧化钙化学性质相似与它们的水溶液中都含有OH﹣有关 D、过氧化氢溶液和二氧化锰混合制得氧气的质量与二氧化锰的质量有关
A、硝酸钾的溶解度随温度的升高而增大 B、降低温度可以使接近饱和的硝酸钾溶液变饱和 C、60℃时120g硝酸钾与100g水充分混合可以形成饱和溶液 D、60℃时硝酸钾溶液的溶质质量分数一定大于30℃时硝酸钾溶液的溶质质量分数12. 下列解释不合理的是( )A、生铁和钢的性能不同于它们的组成中含碳量不同有关 B、铁丝在空气中不能被点燃与空气中氧气的体积分数有关 C、氢氧化钠和氢氧化钙化学性质相似与它们的水溶液中都含有OH﹣有关 D、过氧化氢溶液和二氧化锰混合制得氧气的质量与二氧化锰的质量有关二、解答题(共3小题,满分30分)
-
13. 泉州是“一路一带”的重要组成部分,化学与文化、科技等多方面的融合,使我们的生活绚丽多彩,请回答:(1)、德化瓷器名扬天下,烧制瓷器属于变化.(2)、国家级非物质文化遗产有“元宵花灯”和“提线木偶”等等,元宵花灯采用塑料亚克力(PMMA)制作,替代传统材料,具有经久耐用的特点,PMMA属于材料(选填“无机”或“合成”);提线木偶装饰材料有蚕丝和棉花等,鉴别蚕丝和棉花的方法是 .(3)、地方名小吃“面线糊”,面线中含量最高的营养素是 , 摄入后可为人体 .(4)、开发新能源以缓解能源缺乏和环境污染问题,正开发和利用的新能源有(写一种).提倡使用的电动汽车中的锂空气电池,放电时锂(Li)与水、空气中的氧气反应生成氢氧化锂(LiOH),该反应的化学方程式为 .14. 氧是地壳中含量最多的元素,氧及其化合物是化学学习和研究的重要内容.(1)、
如图氧原子结构示意图获得的信息,正确的是(填标号).

a.
 表示原子核,带8个单位正电荷
表示原子核,带8个单位正电荷b.氧原子核外有2个电子层,有8个电子在核外作高速运动
c.氧原子在化学反应中易失去电子形成离子(O2﹣)
(2)、构成氧气的微粒是 , 氧气经降温和加压变为液态氧后体积变小,用微粒的观点解释: .(3)、水是重要的氧化物,电解水实验说明水是由组成的.登山和潜水供氧装置中,过氧化钠(Na2O2)与水反应,生成氢氧化钠(NaOH)和氧气,有关反应的化学方程式为 .(4)、自然界中氧循环的环节之一:绿色植物的光合作用,有关的化学方程式为6CO2+6H2O
 C6H12O6+XO2 , 则X= , 绿色植物通过光合作用将太阳能转化为能.15.
C6H12O6+XO2 , 则X= , 绿色植物通过光合作用将太阳能转化为能.15.甲、乙、丙、丁是初中化学常见的四种不同类别的物质,它们之间存在如图所示的变化关系,其中“→”表示转化关系,“﹣”表示相互之间能反应(部分反应物、生成物以及反应条件省略).已知:甲是生产生活中应用广泛的金属,丙可用于配制农药波尔多液,其中水溶液呈蓝色.请回答:
 (1)、甲可能是 , 丙是;乙的一种用途是 .(2)、乙和丁反应生成丙,丁可能是 .(3)、写出甲与丙反应的化学方程式 , 该反应的基本类型是 .(4)、将甲与丙溶液充分混合后过滤,往滤渣中加入乙的稀溶液,没有观察到气泡冒出,则滤液中一定存在的阳离子是 , 可能存在的阳离子是 .
(1)、甲可能是 , 丙是;乙的一种用途是 .(2)、乙和丁反应生成丙,丁可能是 .(3)、写出甲与丙反应的化学方程式 , 该反应的基本类型是 .(4)、将甲与丙溶液充分混合后过滤,往滤渣中加入乙的稀溶液,没有观察到气泡冒出,则滤液中一定存在的阳离子是 , 可能存在的阳离子是 .三、解答题(共2小题,满分30分)
-
16.
利用如图所示的实验装置制备常见气体,请回答有关问题:
 (1)、写出标有序号的仪器名称:① .(2)、装置A为气体发生装置,在试管内的适当位置放入、等实验用品以制取氧气,写出有关反应的化学方程式 .(3)、若用装置B收集的氧气不纯,原因可能是(写一种).(4)、用装置C收集氧气,验满时将带火星的木条放在(选填“a”或“b”)处.(5)、装置D是用软塑料管自制的气体发生装置,利用该装置制取二氧化碳气体时,塑料管中加入的液体药品是 , 药品加入完毕后,接下来的操作是: .17. 日常生活中,人们利用碳酸钠溶液具有碱性,清洗餐具上的油污,碱性越强,去油污的效果越好,小菁决定对影响碳酸钠溶液碱性的因素展开探究,请你参与.
(1)、写出标有序号的仪器名称:① .(2)、装置A为气体发生装置,在试管内的适当位置放入、等实验用品以制取氧气,写出有关反应的化学方程式 .(3)、若用装置B收集的氧气不纯,原因可能是(写一种).(4)、用装置C收集氧气,验满时将带火星的木条放在(选填“a”或“b”)处.(5)、装置D是用软塑料管自制的气体发生装置,利用该装置制取二氧化碳气体时,塑料管中加入的液体药品是 , 药品加入完毕后,接下来的操作是: .17. 日常生活中,人们利用碳酸钠溶液具有碱性,清洗餐具上的油污,碱性越强,去油污的效果越好,小菁决定对影响碳酸钠溶液碱性的因素展开探究,请你参与.用不同温度的水,配制溶质质量分数分别为2%、6%和10%的碳酸钠溶液,依次测量溶液的pH,记录数据如下表:
实验编号
a1
a2
a3
b1
b2
b3
c1
c2
c3
溶质质量分数
2%
2%
2%
6%
6%
6%
10%
10%
10%
水的温度(℃)
20
40
60
20
50
60
20
40
70
溶液pH
10.90
11.18
11.26
11.08
11.27
11.30
11.22
11.46
11.50
请你分析表中数据回答:
(1)、溶液碱性最强的是(填实验编号).(2)、要得出碳酸钠溶液的溶质质量分数变化与pH变化关系的结论,可选择的一组实验是(填实验编号),结论是 .(3)、在一定温度范围内,温度的变化与碳酸钠溶液的pH变化关系是 .(4)、将10%的碳酸钠溶液从20℃持续升温到70℃,所测得的pH如下表:温度(℃)
20
30
40
50
60
70
溶液pH
11.22
11.35
11.46
11.48
11.50
11.50
①当温度介于20℃~40℃时,温度对碳酸钠溶液的pH影响比较(选填“大”或“小”).
②小菁将适量碳酸钠粉末洒在沾有油污的餐具上,并冲入适量的热水,再进行擦洗,达到较好的洗涤效果,这是因为 .
(5)、碳酸钠溶于水,有部分碳酸钠能与水发生反应生成氢氧化钠,致使溶液呈碱性.实验室鉴别碳酸钠溶液和氢氧化钠溶液可选用的试剂是(填标号).a.酚酞试液 b.稀盐酸 c.氯化钠溶液 d.氯化钙溶液
(6)、 欲使碳酸钠溶液中的碳酸钠完全转化为烧碱,可在溶液中加入足量的物质(写名称):或 , 并充分搅拌,有关反应的化学方程式为(写一个).四、解答题(共2小题,满分10分)
