浙江省丽水市五校共同体2020-2021学年高一上学期化学10月月考试卷
试卷更新日期:2021-01-07 类型:月考试卷
一、单选题
-
1. 根据物质的组成与性质进行分类,纯碱属于( )A、氧化物 B、酸 C、碱 D、盐2. 溶液、胶体和浊液这三种分散系的本质区别是( )A、是否有丁达尔现象 B、是否能通过滤纸 C、分散质粒子的大小 D、是否均一、透明、稳定3. 下列物质中,能够导电且为电解质的是( )A、Cu B、熔融的MgCl2 C、KNO3晶体 D、盐酸4. 下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A、Fe+CuSO4=FeSO4+Cu B、AgNO3+NaCl=AgCl↓+NaNO3 C、Fe2O3+3CO 2Fe+3CO2 D、2KMnO4 K2MnO4+MnO2+O2↑5. 下列选项中不能用如图表示物质或概念间从属关系的是( )
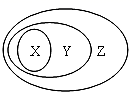
X
Y
Z
A
碱
电解质
化合物
B
离子反应
置换反应
氧化还原反应
C
胶体
分散系
混合物
D
碱性氧化物
金属氧化物
氧化物
A、A B、B C、C D、D6. 下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断错误的是( ) A、1个乙分子中含有2个A原子 B、该反应类型是分解反应 C、相对分子质量:Mr(甲)=Mr(乙)+Mr(丙) D、该反应一定属于氧化还原反应7. 反应Br2+SO2+2H2O=2HBr+H2SO4中,还原产物是( )A、HBr B、H2SO4 C、Br2 D、SO28. NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图1所示,下列说法错误的是( )
A、1个乙分子中含有2个A原子 B、该反应类型是分解反应 C、相对分子质量:Mr(甲)=Mr(乙)+Mr(丙) D、该反应一定属于氧化还原反应7. 反应Br2+SO2+2H2O=2HBr+H2SO4中,还原产物是( )A、HBr B、H2SO4 C、Br2 D、SO28. NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图1所示,下列说法错误的是( ) A、图1中水合钠离子的图示不科学 B、NaCl溶液导电的原因是溶液中有自由移动的Na+和Cl- C、NaCl溶液通电后才发生电离 D、熔融NaCl通电后离子移动方向如图29. 下列物质在水中的电离方程式错误的是( )A、CaCl2=Ca2++2Clˉ B、Ba(OH)2=Ba2++2OH- C、NaHSO4=Na++H++ D、NaHCO3=Na++H++10. 下列有关氧化还原反应的说法正确的是( )A、氧化还原反应的实质是有元素化合价的变化 B、氧化剂发生还原反应,还原剂发生氧化反应 C、一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质 D、金属单质失电子越多,其还原性越强11. 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
A、图1中水合钠离子的图示不科学 B、NaCl溶液导电的原因是溶液中有自由移动的Na+和Cl- C、NaCl溶液通电后才发生电离 D、熔融NaCl通电后离子移动方向如图29. 下列物质在水中的电离方程式错误的是( )A、CaCl2=Ca2++2Clˉ B、Ba(OH)2=Ba2++2OH- C、NaHSO4=Na++H++ D、NaHCO3=Na++H++10. 下列有关氧化还原反应的说法正确的是( )A、氧化还原反应的实质是有元素化合价的变化 B、氧化剂发生还原反应,还原剂发生氧化反应 C、一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质 D、金属单质失电子越多,其还原性越强11. 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( ) A、盐酸中逐滴加入氢氧化钠溶液 B、硫酸铜溶液中逐滴加入氢氧化钡溶液 C、硫酸中逐滴加入氯化钡溶液 D、盐酸中逐滴加入硝酸银溶液12. 在反应 中,被氧化和被还原的硫原子个数比为( )A、1:2 B、2:1 C、1:1 D、3:213. 能在无色溶液中大量共存的一组离子是( )A、H+、Na+、Cl-、 B、H+、Fe3+、 、Cl- C、Ag+、K+、 、Cl- D、K+、Ca2+、OH-、14. 下列说法错误的是( )A、Na着火时,能用泡沫灭火器灭火 B、Na2CO3可用于玻璃、造纸等工业 C、NaHCO3可用于焙制糕点 D、Na2O2可用于制作呼吸面具15. 在下列变化中,必须要加入合适的氧化剂才能实现的是( )A、Na2O2→O2 B、CO2→CO C、Fe2O3→Fe D、I-→I216. 下列关于Na2CO3和NaHCO3的说法错误的是( )A、热稳定性:NaHCO3<Na2CO3 B、在水中的溶解性:NaHCO3<Na2CO3 C、与盐酸反应的速率:NaHCO3<Na2CO3 D、向饱和Na2CO3溶液中通入CO2 , 有NaHCO3晶体析出17. 焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示,下列说法正确的是( )
A、盐酸中逐滴加入氢氧化钠溶液 B、硫酸铜溶液中逐滴加入氢氧化钡溶液 C、硫酸中逐滴加入氯化钡溶液 D、盐酸中逐滴加入硝酸银溶液12. 在反应 中,被氧化和被还原的硫原子个数比为( )A、1:2 B、2:1 C、1:1 D、3:213. 能在无色溶液中大量共存的一组离子是( )A、H+、Na+、Cl-、 B、H+、Fe3+、 、Cl- C、Ag+、K+、 、Cl- D、K+、Ca2+、OH-、14. 下列说法错误的是( )A、Na着火时,能用泡沫灭火器灭火 B、Na2CO3可用于玻璃、造纸等工业 C、NaHCO3可用于焙制糕点 D、Na2O2可用于制作呼吸面具15. 在下列变化中,必须要加入合适的氧化剂才能实现的是( )A、Na2O2→O2 B、CO2→CO C、Fe2O3→Fe D、I-→I216. 下列关于Na2CO3和NaHCO3的说法错误的是( )A、热稳定性:NaHCO3<Na2CO3 B、在水中的溶解性:NaHCO3<Na2CO3 C、与盐酸反应的速率:NaHCO3<Na2CO3 D、向饱和Na2CO3溶液中通入CO2 , 有NaHCO3晶体析出17. 焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示,下列说法正确的是( ) A、铂丝也可用稀硫酸来清洗 B、某溶液进行焰色试验火焰呈黄色,则表明待测液中一定含有Na+ , 可能含有K+ C、焰色试验是化学变化 D、所有金属及其化合物灼烧时火焰均有颜色18. 下列关于Na2O与Na2O2的说法错误的是( )A、二者均可由金属Na与O2反应得到,但是反应条件不同 B、二者在常温下均为固体,但颜色不同 C、Na2O与Na2O2中阴阳离子个数比分别为1:2,1:1 D、Na2O与Na2O2在空气中久置都会发生变质,且最终产物相同19. 下列离子方程式书写正确的是( )A、Na2CO3溶液与少量盐酸反应: +2H+=H2O+CO2↑ B、BaCO3溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ C、澄清石灰水中滴加少量NaHCO3:Ca2++2OH―+2 =CaCO3↓+2H2O+ D、将钠投入水中:2Na+2H2O=2Na++2OH―+H2↑20. 在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )A、FeCl3 B、FeCl2 C、S D、HCl21. 下列关于钠的说法中正确的是( )A、钠投入水中后熔化成小球,说明反应放热,钠的沸点低 B、向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中缓慢地加入一绿豆粒大的金属钠,可能观察到的现象是如图
A、铂丝也可用稀硫酸来清洗 B、某溶液进行焰色试验火焰呈黄色,则表明待测液中一定含有Na+ , 可能含有K+ C、焰色试验是化学变化 D、所有金属及其化合物灼烧时火焰均有颜色18. 下列关于Na2O与Na2O2的说法错误的是( )A、二者均可由金属Na与O2反应得到,但是反应条件不同 B、二者在常温下均为固体,但颜色不同 C、Na2O与Na2O2中阴阳离子个数比分别为1:2,1:1 D、Na2O与Na2O2在空气中久置都会发生变质,且最终产物相同19. 下列离子方程式书写正确的是( )A、Na2CO3溶液与少量盐酸反应: +2H+=H2O+CO2↑ B、BaCO3溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ C、澄清石灰水中滴加少量NaHCO3:Ca2++2OH―+2 =CaCO3↓+2H2O+ D、将钠投入水中:2Na+2H2O=2Na++2OH―+H2↑20. 在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )A、FeCl3 B、FeCl2 C、S D、HCl21. 下列关于钠的说法中正确的是( )A、钠投入水中后熔化成小球,说明反应放热,钠的沸点低 B、向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中缓慢地加入一绿豆粒大的金属钠,可能观察到的现象是如图 C、将钠投入装有硫酸铜溶液的试管里,试管底部有红色物质生成
D、实验室中取用后剩余的钠要放回原试剂瓶中
22. 已知反应:①Cl2+2KBr=2KCl+Br2 ,
C、将钠投入装有硫酸铜溶液的试管里,试管底部有红色物质生成
D、实验室中取用后剩余的钠要放回原试剂瓶中
22. 已知反应:①Cl2+2KBr=2KCl+Br2 ,②KClO3+6HCl=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3 , 下列说法正确的是( )
A、上述三个反应都有单质生成,所以都是置换反应 B、氧化性由强到弱顺序为KBrO3>KClO3>Cl2>Br2 C、反应②中,氧化产物与还原产物的质量比为6:1 D、反应③中若有1个Cl2反应,则KBrO3失去10个电子23. 将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有沉淀产生的是( )①MgSO4溶液②NaCl溶液③Na2SO4溶液④饱和澄清石灰水⑤Ca(HCO3)2溶液
A、① B、①④ C、①④⑤ D、①②④⑤24. 在碱性溶液中,R(OH)3能被ClO-氧化为 ,而ClO-被还原为Cl- , 已知R(OH)3、ClO-的反应个数比2:3,则 中n等于( )A、1 B、2 C、3 D、425. 取某固体样品,进行如下实验①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是( )
A、K2SO4、Ba(OH)2、Na2CO3 B、Na2CO3、AgNO3、KNO3 C、K2CO3、NaCl、Ba(NO3)2 D、KNO3、MgCl2、NaOH二、综合题
-
26.(1)、I.如图是按一定的方法给物质进行的分类。

该物质分类方法名称是 , 类别1是 , 类别2是。
(2)、上述物质中属于电解质的是。(3)、II.同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。生石灰属于(填“酸性氧化物”或“碱性氧化物”)。
(4)、生石灰可作干燥剂的理由是(用化学方程式表示)。(5)、生石灰与稀盐酸反应的离子方程式。27. 央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。(1)、已知有毒胶囊中含有Fe(CrO2)2 , 其中铬元素是+3价,则其中铁元素的化合价为。(2)、区别明胶水溶液和Na2SO4溶液的方法是。(3)、将饱和FeCl3溶液分别滴入下述液体中,也能形成胶体的是____________。A、冷水 B、沸水 C、NaCl溶液 D、NaOH溶液(4)、已知胶体的分散质不能透过半透膜,但小分子或离子能透过半透膜。现将10mL明胶水溶液与5mLNa2SO4溶液混合后装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中。写出能证明Na+透过半透膜的实验方法(具体操作):。28. 下面两个方法都可以用来制氯气:①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。根据以上两个反应,回答下列有关问题:
(1)、反应①的离子方程式为。(2)、浓盐酸在反应①中显示出来的性质是。A.还原性B.氧化性C.酸性
若有17.4gMnO2参与反应,则被氧化的HCl的质量为g。
(3)、用双线桥法表示该反应②中电子转移的方向和数目。(4)、若要制得相同质量的氯气,反应①②中电子转移的数目之比为。(5)、已知反应④:4HCl+O2 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为。29. 图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。
 (1)、写出A的原子结构示意图 , B的化学式。(2)、以上6个反应中属于氧化还原反应的有(填写编号)。(3)、写出B→D反应的化学方程式 , C溶液→E反应的离子方程式。(4)、若用所示装置验证D和E的稳定性,则试管乙中装入的固体最好是(填化学式)。(5)、将一定量的B投入到含有下列离子的溶液中: 、 、 、Na+ , 反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)填离子符号)。30. 现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。
(1)、写出A的原子结构示意图 , B的化学式。(2)、以上6个反应中属于氧化还原反应的有(填写编号)。(3)、写出B→D反应的化学方程式 , C溶液→E反应的离子方程式。(4)、若用所示装置验证D和E的稳定性,则试管乙中装入的固体最好是(填化学式)。(5)、将一定量的B投入到含有下列离子的溶液中: 、 、 、Na+ , 反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)填离子符号)。30. 现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。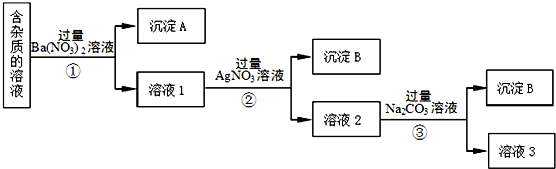 (1)、沉淀A的主要成分是、(填化学式)。
(1)、沉淀A的主要成分是、(填化学式)。
(2)、③中加入过量的Na2CO3溶液的目的是。(3)、溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是 , 为了除去杂质,可向溶液3中加入适量的。31. 将3.8gNa2CO3和NaHCO3的混合物充分加热,混合物质量减少了0.62g。求:(1)、混合物中NaHCO3的质量。(2)、若将等质量的混合物与含有1.46gHCl的稀盐酸反应,生成气体的的质量为。