天津市静海区四校2020-2021学年高二上学期化学12月月考试卷
试卷更新日期:2021-01-07 类型:月考试卷
一、单选题
-
1. 《礼记·内则》记载:“冠带垢,和灰清漱;衣裳垢,和灰清浣。”古人洗涤衣裳冠带,所用的就是草木灰浸泡的溶液。下列说法错误的是( )A、草木灰的主要成分是K2CO3 B、洗涤利用了草木灰溶液的碱性 C、洗涤时加热可增强去油污能力 D、草木灰做肥料时可与铵态氮肥混合施用2. 配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是( )A、较浓盐酸可有效抑制Fe3+水解 B、稀释过程中FeCl3水解程度增大,c(H+)增大 C、FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+ D、FeCl3溶液显黄色,没有Fe(OH)3存在3. 下列事实不能用勒夏特列原理解释的是( )A、常温下将pH=4的醋酸溶液稀释10倍,pH<5 B、H2、I2(g)、HI平衡体系加压后颜色变深 C、利用TiCl4水解制备TiO2时,需加入大量水并加热 D、向Mg(OH)2悬浊液中滴加FeCl3溶液,有红褐色沉淀生成4. 德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是( )
 A、增大压强既可以加快反应速率,又可以提高原料转化率 B、升高温度可提高平衡转化率 C、冷却过程中采用热交换有助于节约能源 D、原料循环可提高其利用率5. 生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g) Hb(O2)。下列说法正确的是( )A、体温升高,O2与Hb结合更快,反应的平衡常数不变 B、吸入新鲜空气,平衡逆向移动 C、CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大 D、高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g) Hb(O2)+CO(g)右移6. 弱电解质在水溶液中的电离过程是一个可逆过程。常温下,关于弱电解质的电离过程,说法正确的是( )A、0.1mol∙L-1醋酸溶液加水稀释,溶液中 减小 B、水是极弱的电解质,将NaHSO4加入水中,水的电离程度增大 C、pH=3的醋酸溶液加水稀释10倍后3<pH<4 D、若电离平衡向正向移动,则弱电解质的电离度一定增大7. 一定温度下,一容积可变的密闭容器中发生反应A(s) +3B(g) 2C(g) +D(g),经2 min B的浓度减少0.6 mol·L-1 , 下列说法正确的是( )A、若起始时A,B的物质的量之比为1:3,则2 min末A、B的转化率相等 B、用A表示的反应速率是0.1 mol·L-1· min-1 C、2 min末的反应速率v(C)=0.2 mol·L-1·min-1 D、该反应的平衡常数表达式为K=8. 下列水溶液一定呈中性的是( )A、pH=7的溶液 B、c(H+)=1.0×10-7mol·L-1的溶液 C、c(H+)=c(OH-)的溶液 D、pH=3的酸与pH=11的碱等体积混合后的溶液9. 下列有关实验现象和解释或结论都正确的是( )
A、增大压强既可以加快反应速率,又可以提高原料转化率 B、升高温度可提高平衡转化率 C、冷却过程中采用热交换有助于节约能源 D、原料循环可提高其利用率5. 生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g) Hb(O2)。下列说法正确的是( )A、体温升高,O2与Hb结合更快,反应的平衡常数不变 B、吸入新鲜空气,平衡逆向移动 C、CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大 D、高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g) Hb(O2)+CO(g)右移6. 弱电解质在水溶液中的电离过程是一个可逆过程。常温下,关于弱电解质的电离过程,说法正确的是( )A、0.1mol∙L-1醋酸溶液加水稀释,溶液中 减小 B、水是极弱的电解质,将NaHSO4加入水中,水的电离程度增大 C、pH=3的醋酸溶液加水稀释10倍后3<pH<4 D、若电离平衡向正向移动,则弱电解质的电离度一定增大7. 一定温度下,一容积可变的密闭容器中发生反应A(s) +3B(g) 2C(g) +D(g),经2 min B的浓度减少0.6 mol·L-1 , 下列说法正确的是( )A、若起始时A,B的物质的量之比为1:3,则2 min末A、B的转化率相等 B、用A表示的反应速率是0.1 mol·L-1· min-1 C、2 min末的反应速率v(C)=0.2 mol·L-1·min-1 D、该反应的平衡常数表达式为K=8. 下列水溶液一定呈中性的是( )A、pH=7的溶液 B、c(H+)=1.0×10-7mol·L-1的溶液 C、c(H+)=c(OH-)的溶液 D、pH=3的酸与pH=11的碱等体积混合后的溶液9. 下列有关实验现象和解释或结论都正确的是( )选项
实验操作
现象
解释或结论
A
将氯化铁溶液加热灼烧
有固体析出
该固体是氯化铁
B
氯化铜溶液中有氯化铁杂质,加入氧化铜除杂
有红褐色物质析出
调节pH使铁离子水解平衡右移
C
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
反应2NO2 N2O4的△H>0
D
向1 mL 0.1 mol/L的AgNO3溶液中加入4滴0.1 mol/L的NaCl溶液,再加10滴0.1 mol/L的NaI溶液,再振荡
先生成白色沉淀,后产生黄色沉淀
Ksp(AgI)<Ksp(AgCl)
A、A B、B C、C D、D10. 物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )A、Ba(OH)2、Na2CO3、FeCl3、KCl B、NaOH、Na2CO3、KNO3、NH4Cl C、NH3·H2O、HCl、Na2SO4、H2SO4 D、NaHCO3、醋酸、NaCl、HCl11. 下列有关说法正确的是( )A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B、已知C(石墨,s)=C(金刚石,s) ΔH>0,故金刚石比石墨稳定 C、放热且熵增加的反应不一定能正向自发进行 D、升高温度能增大单位体积内的活化分子数,加快反应速率12. 下列说法正确的是( )A、某放热反应能自发进行,则该反应一定是熵增的反应 B、0.1mol·L-1CH3COONa溶液与0.05mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) C、等浓度的①(NH4)2SO4②NH4HSO4③NH4Cl三种溶液中c(NH )大小:①>③>② D、25℃时pH=3的盐酸、pH=3的氯化铵溶液中水电离出的c(H+)均为10-11mol·L-113. 下列条件下,对应离子一定能大量共存的是( )A、在0.1mol/LNa2CO3溶液中:Al3+、 、 、 B、pH=7的溶液中:Fe3+、Cl-、Na+、 C、使甲基橙变红的溶液中: 、Cl-、 、Mg2+ D、25℃时,水电离出的 c(H+)=1×10-13 mol/L的溶液中:K+、Ba2+、 、S2-14. 常温下,浓度均为0.1mol·L-1的下列四种盐溶液,其pH测定如表所示:序号
①
②
③
④
溶液
CH3COONa
NaHCO3
Na2CO3
NaClO
pH
8.8
9.7
11.6
10.3
下列说法正确的是( )
A、四种溶液中,水的电离程度:①>②>④>③ B、Na2CO3和NaHCO3溶液中,粒子种类相同 C、将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO D、Na2CO3溶液中,c(Na+)=2c( )+c( )+c(H2CO3)15. 常温下,用0.1000mol·L-1的NaOH溶液滴定20.00mL未知浓度的某酸HX,滴定曲线如图所示。下列说法正确的是( )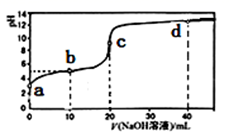 A、该酸的常温下的电离常数约为1×10-5 B、d点的溶液中:c(Na+)<c(X-) C、需用甲基橙作指示剂 D、b点溶液中:c(HX)>c(Na+)>c(H+)>c(OH-)
A、该酸的常温下的电离常数约为1×10-5 B、d点的溶液中:c(Na+)<c(X-) C、需用甲基橙作指示剂 D、b点溶液中:c(HX)>c(Na+)>c(H+)>c(OH-)二、填空题
-
16. ①碳酸氢钠②醋酸钠③碳酸钠④硫酸铝(1)、Ⅰ.将上述①③④的水溶液加热并蒸干,其中能得到相应的盐的是(填序号);①的水溶液显碱性,因此水解电离(写“大于”“小于”“等于”),②中离子浓度由大到小排列。(2)、Ⅱ.已知水的电离平衡曲线如图所示:

图中C点水的离子积常数为。
(3)、从A点到D点,可采取的措施是。a.升温
b.加入少量盐酸
c.降温
d.加入少量NaOH
(4)、100℃时,pH=2的盐酸中水电离产生的H+浓度为。(5)、25℃时,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为。(6)、能证明醋酸是弱酸的是。a.醋酸钠溶液显碱性
b.醋酸能与水互溶
c.0.1mol·L-1醋酸溶液的pH=3
d.盐酸可与醋酸钠反应
17. 研究一个化学反应往往需要关注反应的快慢和历程,请利用相关理论答题。(1)、Ⅰ.T℃时,反应①CO2(g)+Fe(s) CO(g)+FeO(s)的化学平衡常数为K1 , ②H2O(g)+Fe(s) H2(g)+FeO(s)的化学平衡常数为K2。回答下列问题:反应①的化学平衡常数表达式为K1=。
(2)、T℃时,若反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数为K , 则K=(用K1、K2表示)(3)、Ⅱ.在一容积为2L的密闭容器中充入4molCO2和6molH2 , 进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:t/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
①该反应为反应(选填吸热、放热)。
②830℃、保持容器容积不变,能判断该反应达到化学平衡状态的依据是。
A.c(CO)=c(CO2)
B.容器内CO2的体积分数保持不变
C.容器内气体密度保持不变
D.容器中压强保持不变
E.单位时间内有amolH-H形成同时有amolH-O形成
③830℃时,向②平衡体系中再充入1.2molH2和1.2molCO,则平衡移动(选填正向、逆向或不移动)。
(4)、III.亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2 2ClNO(g)。已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
化学键
N≡O
Cl-Cl
Cl-N
N=O
键能/kJ·mol-1
a
b
c
d
则2NO(g)+Cl2 2ClNO(g)反应,ΔH=kJ/mol。(用字母表示)
18. 已知如下表数据(25℃):物质
CH3COOH
NH3·H2O
HCN
H2CO3
电离常数(K)
1.7×10-5
1.7×10-5
4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
(1)、25℃时,将等体积等浓度的醋酸和氨水混合,混合溶液的pH7(填“>”、“=或“<);该混合溶液中水的电离会受到(填“促进”、“抑制”、“既不促进也不抑制”)。(2)、NaCN溶液呈性,用离子方程式解释原因。(3)、写出泡沫灭火器原理(离子方程式)(4)、现有浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合之后(忽略混合过程中溶液体积的改变),测得c(Na+)>c(CN-),下列关系正确的是(________)A、c(H+)>c(OH-) B、c(HCN)>c(CN-) C、c(H+)+c(HCN)=c(OH-)+c(CN-) D、c(HCN)+c(CN-)=0.01mol/L三、实验题
-
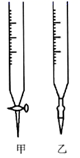
19. 某学生欲用已知浓度的氢氧化钠标准溶液来滴定未知浓度的盐酸溶液,以酚酞试液为滴定指示剂。请填写下列空白:(1)、用标准NaOH溶液滴定时,应将标准NaOH溶液注入图中(填“甲”或“乙”)中。
 (2)、碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是。(3)、若第一次滴定开始和结束时,碱式滴定管中的液面如图所示,请将数据填入下面表格的横线处。
(2)、碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是。(3)、若第一次滴定开始和结束时,碱式滴定管中的液面如图所示,请将数据填入下面表格的横线处。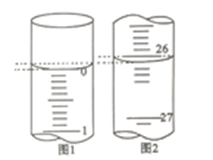
滴定次数
待测盐酸溶液的体积/mL
0.1000 mol·L-1氢氧化钠的体积/mL
滴定前刻度
滴定后刻度
溶液体积/mL
第一次
25.00
0.00
第二次
25.00
1.00
26.80
25.80
第三次
25.00
2.00
28.10
26.10
第四次
25.00
0.22
29.17
28.95
(4)、请根据表中数据计算该盐酸溶液的物质的量浓度c(HCl)=。(5)、请简述滴定终点的判定。(6)、下列操作中可能使所测盐酸溶液的浓度偏低的。A碱式滴定管在滴定前有气泡,滴定后气泡消失
B滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C量取一定体积的待测液,最后读数时滴定管尖嘴处悬挂一滴溶液
D读取氢氧化钠溶液体积时,开始时仰视读数,滴定结束时俯视读数