2016年湖北省宜昌市中考化学试卷
试卷更新日期:2016-07-04 类型:中考真卷
一、选择题(共18小题,每小题3分,满分54分)
-
1. 下列变化中,属于化学变化的是( )A、酒精挥发 B、湿衣晾干 C、冰雪融化 D、纸张燃烧2. 空气中含量最多的气体是( )A、氧气 B、氮气 C、二氧化碳 D、水蒸气3. 宜昌“富硒茶”是较好的保健饮品,这里的“硒”指的是( )A、原子 B、分子 C、元素 D、单质4. 要补充维生素,可以在饮食中适量增加( )A、蔬菜 B、米饭 C、豆油 D、瘦肉5.
2016年6月5日世界环境日中国主题是“改善环境质量,推动绿色发展”.下列做法符合这一主题的是( )
 A、鼓励燃煤发电,确保电力供应 B、提倡公交出行,减少尾气排放 C、就地焚烧秸秆,增加田间肥料 D、燃放烟花爆竹,增强节日气氛6. 下列实验现象描述正确的是( )A、铁丝伸入盛氧气的集气瓶中剧烈燃烧 B、红磷在空气中燃烧产生大量白雾 C、硫燃烧时生成有刺激性气味的气体 D、氢氧化钠溶于水时溶液温度降低7. 下列实验操作正确的是( )A、闻气体气味
A、鼓励燃煤发电,确保电力供应 B、提倡公交出行,减少尾气排放 C、就地焚烧秸秆,增加田间肥料 D、燃放烟花爆竹,增强节日气氛6. 下列实验现象描述正确的是( )A、铁丝伸入盛氧气的集气瓶中剧烈燃烧 B、红磷在空气中燃烧产生大量白雾 C、硫燃烧时生成有刺激性气味的气体 D、氢氧化钠溶于水时溶液温度降低7. 下列实验操作正确的是( )A、闻气体气味 B、稀释浓硫酸
B、稀释浓硫酸 C、倾倒液体
C、倾倒液体 D、读取液体体积
D、读取液体体积 8.
8.蚊虫叮咬时会分泌蚁酸,使叮咬处肿大痛痒.为缓解症状,最好涂抹( )
 A、苹果汁 B、牛奶 C、肥皂水 D、炉具清洁剂9. 强化安全意识,提升安全素养.下列采取的安全措施错误的是( )A、在点燃氢气前先检验其纯度 B、在火灾逃生时用湿毛巾捂住口鼻 C、在加油站张贴严禁烟火标志 D、在天然气燃气罩下方安装报警器10.
A、苹果汁 B、牛奶 C、肥皂水 D、炉具清洁剂9. 强化安全意识,提升安全素养.下列采取的安全措施错误的是( )A、在点燃氢气前先检验其纯度 B、在火灾逃生时用湿毛巾捂住口鼻 C、在加油站张贴严禁烟火标志 D、在天然气燃气罩下方安装报警器10.溴元素的原子结构示意图及其在周期表中的信息如图所示.下列说法错误的是( )
 A、n=5 B、该元素为非金属元素 C、形成的离子是Br﹣ D、原子序数为3511. K2MnO4中Mn元素的化合价是( )A、+4 B、+5 C、+6 D、+712.
A、n=5 B、该元素为非金属元素 C、形成的离子是Br﹣ D、原子序数为3511. K2MnO4中Mn元素的化合价是( )A、+4 B、+5 C、+6 D、+712.某纯净物M燃烧的化学方程式为:M+3O2
 2CO2+2H2O,则M的化学式是( )A、C2H2 B、C2H4 C、C2H6 D、C2H4O13. “部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,如表是截取溶解性表中的一部分,有关①处物质的说法不正确的是( )
2CO2+2H2O,则M的化学式是( )A、C2H2 B、C2H4 C、C2H6 D、C2H4O13. “部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,如表是截取溶解性表中的一部分,有关①处物质的说法不正确的是( )阴离子 阳离子
OH﹣
Cl﹣
…
…
…
Fe3+
不
①
…
…
…
A、①处物质的化学式是FeCl2 B、①处物质的名称是氯化铁 C、①处物质可溶于水 D、①处物质类别属于盐14. 除去下列物质中的少量杂质,实验方案不能达到除杂目的是( )物质(括号内为杂质)
实验方案
A
氮气(氧气)
通过足量灼热铜网
B
氧化铜(木炭粉)
在空气中充分灼烧
C
铜粉(铁粉)
加入足量稀盐酸,过滤,洗涤,干燥
D
硫酸锌溶液(硫酸)
加入足量氧化铁粉末,过滤
A、A B、B C、C D、D15. 能验证Zn、Cu、Ag三种金属活动性顺序的一组试剂是( )A、Zn、Ag、CuSO4溶液 B、Zn、Cu、Ag、H2SO4溶液 C、Cu、Ag、ZnSO4溶液 D、Ag、ZnSO4溶液、CuSO4溶液16.如图中“﹣”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,部分反应物、生成物及反应条件未标出.则不可能出现的情况是( )
 A、甲是H2、乙是O2 B、甲是HNO3 , 丙是NaNO3 C、乙是CO,丙是CO2 D、乙是Cu(OH)2、丙是CuSO417.
A、甲是H2、乙是O2 B、甲是HNO3 , 丙是NaNO3 C、乙是CO,丙是CO2 D、乙是Cu(OH)2、丙是CuSO417.下列实验能用如图表示的是( )
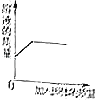 A、向硫酸铜溶液中加入铁粉 B、向过氧化氢溶液中加入二氧化锰 C、向一杯接近饱和的石灰水中加入氧化钙 D、向不饱和的硝酸钾溶液中加入硝酸钾18. 下列归纳总结完全正确的一组是( )
A、向硫酸铜溶液中加入铁粉 B、向过氧化氢溶液中加入二氧化锰 C、向一杯接近饱和的石灰水中加入氧化钙 D、向不饱和的硝酸钾溶液中加入硝酸钾18. 下列归纳总结完全正确的一组是( )A.化学之最
B.化学与生活
①熔点最低的金属是汞
②地壳中含量最高的金属元素是铁
③天然存在的最硬的物质是金刚石
①衣服上的油污:可用汽油除去
②水壶中的水垢:可加食盐水浸泡除去
③冰箱中的异味:可放活性炭吸附
C.物质保存方法及解释
D.化学与工农业
①浓盐酸密封保存:防止挥发
②白磷在冷水中保存:隔绝空气
③氢氧化钠密封保存:防止潮解、变质
①用焦炭和铁矿石炼铁
②用石油产品生产合成纤维
③施用过量化肥,农药增加粮食产量
A、A B、B C、C D、D二、填空题(共3小题,每小题1.5分,满分7分)
-
19. 填写表格
化学符号
①
2N
③
名称或意义
磷元素
②
3个过氧化氢分子
20. 学习生活中的化学,解释生活中的现象,化学就在我们身边.(1)、如图是常见的电源插头,在标示的部分中,属于有机合成材料的是 .
 (2)、铜能制成插头和导线,是利用了金属铜的性和性.(3)、厕所用清洁剂(含盐酸)不慎洒到大理石地面上,会发出嘶嘶声.用化学方程式表示原因: .(4)、我国药学家屠呦呦因研制新型抗疟药膏素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.东晋名医葛洪《肘后备急方》中就有青蒿素抗疟的记载:“青蒿一握,以水二升渍,绞取汁,尽服之”.这里的“水”作 . 上述水煎青蒿治疗疟疾,药性很不稳定,效果很差,屠呦呦改用乙醇提取,控温60℃,药性显著提高,说明青蒿素具有的性质是(答一条): .21.
(2)、铜能制成插头和导线,是利用了金属铜的性和性.(3)、厕所用清洁剂(含盐酸)不慎洒到大理石地面上,会发出嘶嘶声.用化学方程式表示原因: .(4)、我国药学家屠呦呦因研制新型抗疟药膏素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.东晋名医葛洪《肘后备急方》中就有青蒿素抗疟的记载:“青蒿一握,以水二升渍,绞取汁,尽服之”.这里的“水”作 . 上述水煎青蒿治疗疟疾,药性很不稳定,效果很差,屠呦呦改用乙醇提取,控温60℃,药性显著提高,说明青蒿素具有的性质是(答一条): .21.甲、乙、丙三种固体物质的溶解度曲线如图所示.据图回答问题:
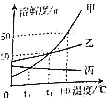 (1)、80℃时,甲物质的溶解度是 .(2)、t2℃,把甲、乙、丙三种物质的饱和溶液降温到t1℃,溶质质量分数不变的是 .(3)、t2℃时,把20g乙物质加到50g水中,充分搅拌后所得溶液的质量是g;若要让乙物质从它的饱和溶液中全部结晶析出,应采取的方法是 .
(1)、80℃时,甲物质的溶解度是 .(2)、t2℃,把甲、乙、丙三种物质的饱和溶液降温到t1℃,溶质质量分数不变的是 .(3)、t2℃时,把20g乙物质加到50g水中,充分搅拌后所得溶液的质量是g;若要让乙物质从它的饱和溶液中全部结晶析出,应采取的方法是 .三、解答题(共2小题,满分7.5分)
-
22. “魔力蜡烛”可以增加生日宴会气氛.制造蜡烛时,在烛心中掺入镁粉(镁粉在430℃时能自燃).每次吹灭蜡烛时,余烬会引燃烛心中的镁粉,产生火花,又重新电燃蜡烛.(1)、镁粉燃烧的化学方程式为 .(2)、“魔力蜡烛”能“死灰复燃”,说明燃烧的条件之一是 .23.
如图是实验室常用气体制备装置,据图回答问题:
 (1)、用A装置制取氧气的化学方程式是 . 选择D装置收集氧气是因为 . 将带火星的木炭深入盛有氧气的集气瓶中,木炭剧烈燃烧,发出白光,说明氧气能 , 该反应的化学方程式为 .(2)、
(1)、用A装置制取氧气的化学方程式是 . 选择D装置收集氧气是因为 . 将带火星的木炭深入盛有氧气的集气瓶中,木炭剧烈燃烧,发出白光,说明氧气能 , 该反应的化学方程式为 .(2)、实验室制取氨气:Ca(OH)2(固)+2NH4Cl(固)
 CaCl2(固)+2H2O+2NH3↑,要制取并收集干燥的氨气,所选装置正确的连接顺序是→→(填字母代号).(3)、
CaCl2(固)+2H2O+2NH3↑,要制取并收集干燥的氨气,所选装置正确的连接顺序是→→(填字母代号).(3)、为探究氨气的性质,按如图装置进行实验.观察到黑色粉末变红,白色无水硫酸铜变蓝,同时反应中还有一种气体单质生成.

【查阅资料】Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O.
【提出问题】得到的红色物质是什么?
【猜想】①是Cu;②是Cu2O;③是 .
若猜想①成立,玻璃管中发生反应的化学方程式为 , 说明NH3具有性.
【设计实验】请你设计一个简单的实验来验证红色物质中是否存在Cu2O: .
四、解答题(共3小题,满分6.5分)
-
24. 氢气是理想的清洁高能燃料,以水为原料生产氢气的方法有多种.(1)、方法Ⅰ:电解水法.写出电解水的化学方程式 .(2)、
方法Ⅱ:光解水法.我国科学家已研制出在新型高效光催化剂作用下,利用太阳能分解水制氢气.水在通过并接触催化剂表面时,分解的微观过程用示意图表示如下:(“○”表示氢原子,“●”表示氧原子,“▁”表示催化剂).

则水分解微观过程的正确顺序是 (填数字序号).上述过程中,不能再分的粒子是 .
25.控制变量,设计对比实验是实验探究的重要方法.
实验编号
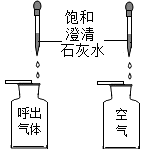
一、探究人体呼出气体中二氧化碳含量比空气中的高
二、探究影响品红扩散快慢的因素
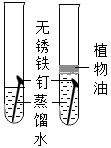
三、铁钉锈蚀条件的探究
实验设计

实验分析
本实验条件除了要控制两个盛装气体样品的集气瓶大小规格相同外,还要控制 相同
发现两杯水都变红,且整杯热水变红时间比冷水要短.由此说明:分子在不断运动;影响分子运动快慢的因素有 .
一周后,左边试管中铁钉生锈,右边试管中铁钉无明显变化.上述实验 (填“能”或“不能”)得出铁钉生锈的条件.
26.工业烟气脱硫就是将烟气中含有的二氧化硫除去.一种采用“双碱法”脱硫的工业流程示意图如图:
 (1)、吸收塔中,用NaOH溶液吸收SO2 , 生成和H2O.NaOH溶液喷成雾状能充分吸收SO2的原因是 .(2)、沉淀室中,发生反应的化学方程式为 .(3)、氧化室中,化学反应的基本类型是反应.(4)、上述流程中,可以循环利用的物质是 , 有利于节约成本.
(1)、吸收塔中,用NaOH溶液吸收SO2 , 生成和H2O.NaOH溶液喷成雾状能充分吸收SO2的原因是 .(2)、沉淀室中,发生反应的化学方程式为 .(3)、氧化室中,化学反应的基本类型是反应.(4)、上述流程中,可以循环利用的物质是 , 有利于节约成本.五、解答题(共1小题,满分6分)
-
27. 设计方案是实验探究的保证,感悟方法是探究的根本目的.某合作学习小组开展了如下探究.
实验一:检验氢氧化钠溶液中是否含有氢氧化钙.
(1)、【分析】从组成上看,氢氧化钙和氢氧化钠都属于碱,它们在水溶液中都能解离出相同的(填符号),所以具有相似的化学性质.但由于解离出的Na+和Ca2+不同,所以性质也有不同.设计实验时可加入能解离出CO32﹣的试剂利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验.(2)、【设计方案并实验】实验操作
现象
结论
方案一
取少量待测溶液于试管中,通入CO2
出现白色沉淀
氢氧化钠溶液中含有氢氧化钙
方案二
取少量待测溶液于试管中,请加溶液
出现白色沉淀
写出上述方案中出现白色沉淀的一个化学方程式 .
(3)、【方法感悟】在检验物质时,要分析物质的组成和 . 据此选择加入恰当的试剂,最后根据不同现象得出结论.(4)、【实验探究】
实验二:有一种白色固体,可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种,为探究其组成,某合作学习小组设计方案并进行了如图实验:

①上述实验中,过滤操作用到的玻璃仪器有:烧杯、玻璃棒和 .
②小晶同学通过上述实验推知:白色固体样品中一定不含有 .
③为确定白色固体样品中可能存在的物质,小燕对沉淀C进行实验.
实验操作
现象
结论
取少量沉淀C于试管中,加入过量 .
有气泡产生,沉淀全部消失.
白色固体样品中一定含有 .
④小虎同学认为白色固体中还要物质不能确认其是否存在.其理由是(用化学方程式表示): . 如要确认,只需将上述实验方案中所加的一种试剂改为即可.
【方法感悟】若其他物质的存在对所检验的物质有干扰时,可先将干扰物质转化,再选择加入恰当的试剂,最后根据不同现象得出结论.
六、解答题(共2小题,满分5分)