初中化学人教版九年级上册计算题专项训练卷
试卷更新日期:2021-01-03 类型:复习试卷
一、计算题
-
1.(1)、某加碘低钠盐的标签部分说明如图所示。

①碘酸钾(KIO3)中各元素的原子个数比为。
②碘酸钾(KIO3)碘元素的质量分数为。
③若该低钠盐中碘元素含量为 25mg/kg,中国营养学会推荐成年人每天摄入碘的量为 0.15mg,若其中 90%来源于食盐,则每天食用该碘盐的质量是g。
(2)、某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品 20g,把 100g 稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,也不与稀盐酸反应)。请计算:序号
加入稀盐酸的质量/g
剩余固体的质量/g
第一次
25
14
第二次
25
8
第三次
25
5
第四次
25
n
表中 n 的数值为。
(3)、求完全反应后生成的二氧化碳的质量是多少?(写出计算过程,精确到 0.1)2. 为了测定某石灰石样品中碳酸钙的含量,小敏同学取12.5g该样品进行实验,然后将100mL稀盐酸分五次加入该样品中,充分反应后测得每次生成气体的质量如下表所示(样品中的杂质不反应,生成的气体全部逸出)。第1次
第2次
第3次
第4次
第5次
加入稀盐酸的体积/mL
20
20
20
20
20
生成气体的质量/g
1.1
1.1
1.1
1.1
0
请计算:
(1)、生成气体的总质量是g(2)、该石灰石样品中碳酸钙的质量分数。3. 鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g干燥的鸡蛋壳,捣碎放在烧杯中,然后向其中滴加某浓度的稀盐酸滴加过程中产生气体质量与所加稀盐酸质量的关系如图所示(鸡蛋壳中除CaCO3外的其他成分都不溶于水,也不与稀盐酸反应)。试计算: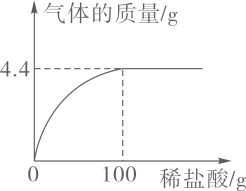 (1)、产生CO2的质量为g。(2)、该鸡蛋壳中CaCO3的质量分数;(3)、所用稀盐酸溶质的质量分数。4. 我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如下:
(1)、产生CO2的质量为g。(2)、该鸡蛋壳中CaCO3的质量分数;(3)、所用稀盐酸溶质的质量分数。4. 我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如下:实验次数
第一次
第二次
第三次
第四次
石灰石样品/g
25
15
10
5
烧杯中物质总质量/g
316.2
326.8
m
337.4
(1)、CaCO3中钙、碳、氧三种元素的质量比为多少;(写最简比)(2)、表中m=;(3)、所用稀盐酸的溶质质量分数为多少;(4)、求该石灰石样品中CaCO3的质量分数。(写出计算过程)5. 某中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。根据以下信息计算: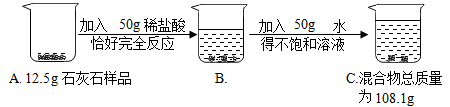 (1)、生成二氧化碳的质量为g;(2)、样品中碳酸钙的质量分数是多少?(3)、C烧杯中溶液的溶质的质量分数是多少?6. 实验室为了测定过氧化氢溶液的质量分数,称取85.00gH2O2溶液和2.0gMnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯的总质量随时间变化如下表所示:
(1)、生成二氧化碳的质量为g;(2)、样品中碳酸钙的质量分数是多少?(3)、C烧杯中溶液的溶质的质量分数是多少?6. 实验室为了测定过氧化氢溶液的质量分数,称取85.00gH2O2溶液和2.0gMnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯的总质量随时间变化如下表所示:时间/S
15
30
45
60
75
90
烧杯总质量/g
136.50
136.10
135.70
135.50
135.40
135.40
(1)、产生O2的质量为g。(2)、过氧化氢溶液中溶质的质量分数为?(写出计算过程)7. 某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图所示。
试验编号
H2O2的质量分数(%)
H2O2溶液的体积(mL)
对应曲线
Ⅰ
3.4
10.0
a
Ⅱ
2.4
10.0
b
Ⅲ
1.7
10.0
c(待绘制)
(1)、实验前需准备不同浓度的H2O2溶液,若要配制100g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液g。(2)、根据实验探究目的,从曲线a、b中,可得出的结论是。(3)、计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5-5.0%H2O2溶液的密度取值1.0g/mL)。(4)、在图中画出曲线c的大致位置及趋势。8. 实验室用12.5g含碳酸钙80%的石灰石和一定质量的稀盐酸反应制取二氧化碳〔石灰石中的杂质不溶于水,也不与稀盐酸反应),加入稀盐酸的质量与产生气体的质量关系如图所示,试计算该稀盐酸中溶质的质量分数。 9. 为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算:
9. 为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算: (1)、这种贝壳中碳酸钙的质量分数是(2)、25g贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量为多少?(写出计算步骤)(3)、本实验是否可以用稀硫酸代替稀盐酸完成实验,并说明理由。10. 实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。
(1)、这种贝壳中碳酸钙的质量分数是(2)、25g贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量为多少?(写出计算步骤)(3)、本实验是否可以用稀硫酸代替稀盐酸完成实验,并说明理由。10. 实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。 (1)、二氧化锰作为催化剂在化学反应前后本身的和都没有发生变化。(2)、过氧化氢中氧元素的化合价为;反应生成氧气的质量为g。(3)、参加反应的过氧化氢溶液中溶质质量分数是多少?(写出计算过程)11. 向10g大理石样品中分两次加入一定溶质质量分数的稀盐酸(杂质不溶于水,也不与稀盐酸反应),充分反应后烧杯内物质总质量的变化如图所示。
(1)、二氧化锰作为催化剂在化学反应前后本身的和都没有发生变化。(2)、过氧化氢中氧元素的化合价为;反应生成氧气的质量为g。(3)、参加反应的过氧化氢溶液中溶质质量分数是多少?(写出计算过程)11. 向10g大理石样品中分两次加入一定溶质质量分数的稀盐酸(杂质不溶于水,也不与稀盐酸反应),充分反应后烧杯内物质总质量的变化如图所示。
请计算:
(1)、生成二氧化碳的质量为g。(2)、所用稀盐酸的溶质质量分数。(写出计算过程)12. 我市石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品10.0g 于烧杯中,将100g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下。次数
1
2
3
4
5
加入稀盐酸质量/g
20
20 20 20
20
剩余固体质量/g
8.0
6.0
4.0
2.5
X
请计算:
(1)、X的值为。(2)、该石灰石样品中碳酸钙的质量分数为。(3)、所用稀盐酸溶质的质量分数。(写出计算过程)。13. 2019年年末,高传染性“新冠肺炎”在我国部分地区流行,由于病发于春运期间,有大量的人员流动,在短时间内病毒就蔓延到了全中国,并在2020年3月席卷全球。在国家及常的领导下“万众一心,众志成城,抗击新冠”,是当前和今后一段时间内摆在全国人民面前的一项重大而艰巨的任务。进行合理的药物消毒是预防新冠病毒感染的重要手段之一。过氧乙酸是较为有效的一种消毒剂,其化学式为CH3COOOH,根据过氧乙酸的化学式进行计算。(1)、过氧乙酸中所含元素质量分数最小的是:(写元素名称)。(2)、计算过氧乙酸中碳、氢、氧元素的质量比:(最简整数比)。(3)、计算过氧乙酸中氧元素的质量分数。(写出计算过程,结果精确到1%)(4)、计算126克过氧乙酸中含氧元素的质量。(写出计算过程,计算结果保留整数)14. 钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄人量,现将20片该药剂制成粉末(主要成分为碳酸钙,每片1g,其他成分不与盐酸反应且不含钙元素),并与50g盐酸混合,充分反应后得到如下图像,请根据有关信息回答问题。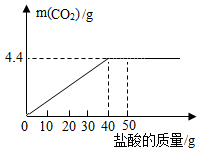 (1)、反应结束共生成二氧化碳的质量为g。(2)、计算每片药剂中所含碳酸钙的质量分数?(3)、反应结束后,溶液中的阳离子主要为(写离子符号)15. 某化学兴趣小组取氯酸钾和二氧化锰的固体混合物若干克,加热至不再产生气体为止.他们通过加水测定剩余固体质量的方法来求出氧气的质量.实验结果如表:(提示:MnO2是不溶于水的固体粉末)
(1)、反应结束共生成二氧化碳的质量为g。(2)、计算每片药剂中所含碳酸钙的质量分数?(3)、反应结束后,溶液中的阳离子主要为(写离子符号)15. 某化学兴趣小组取氯酸钾和二氧化锰的固体混合物若干克,加热至不再产生气体为止.他们通过加水测定剩余固体质量的方法来求出氧气的质量.实验结果如表:(提示:MnO2是不溶于水的固体粉末)实验序号
1
2
3
4
加水的质量(g)
15
15
15
15
剩余固体的质量(g)
14.1
9.3
m
4
请回答下列问题:
(1)、表中m值为;(2)、兴趣小组所取用的固体混合物中,氯酸钾为多少克?16. 为测定鸡蛋壳中钙元素的质量分数,小华同学取10g洗净、晾干并研磨成粉末的鸡蛋壳于烧杯中,向烧杯中加入稀盐酸,测得产生气体和加入稀盐酸的数据如下表(鸡蛋壳的主要成分是碳酸钙,其它成分不能与盐酸反应产生气体,也不含有钙元素):加入稀盐酸质量/g
20
40
60
80
100
产生的气体质量/g
0.88
1.76
2.64
3.52
3.96
(1)、鸡蛋壳中碳酸钙的质量是多少?写出计算过程。(2)、鸡蛋壳中钙元素的质量分数是。实验过程中对测定钙元素的质量分数有影响的有(填序号)
A.盐酸的质量分数过大
B.鸡蛋壳没有充分研磨
C.鸡蛋壳没有晾干
(3)、在下图中画出鸡蛋壳加入稀盐酸质量为0~100g时产生的气体与加入稀盐酸变化的曲线。