初中化学人教版九年级下册工业流程题训练
试卷更新日期:2020-12-31 类型:复习试卷
一、综合题
-
1. 小刚收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水。他的实验过程和部分实验装置如下所示。请回答以下问题:
 (1)、向河水中加入A物质,是利用该物质溶于水后生成的胶状物对杂质的吸附,使杂质沉降,则加入的A物质是;(2)、操作①的名称是 , 在图Ⅲ中还存在一处明显的不正确是;(3)、液体C有异味,操作②选用的装置Ⅱ中应放入的物质是;(4)、利用装置Ⅰ经操作③得到蒸馏水后,加入肥皂水并振荡,看到的现象是。2. 空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程图。请按要求回答下列问题:
(1)、向河水中加入A物质,是利用该物质溶于水后生成的胶状物对杂质的吸附,使杂质沉降,则加入的A物质是;(2)、操作①的名称是 , 在图Ⅲ中还存在一处明显的不正确是;(3)、液体C有异味,操作②选用的装置Ⅱ中应放入的物质是;(4)、利用装置Ⅰ经操作③得到蒸馏水后,加入肥皂水并振荡,看到的现象是。2. 空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程图。请按要求回答下列问题: (1)、转化①中发生的是变化(选填“物理”或“化学”);(2)、请写出转化③处发生反应的化学方程式;(3)、上述化学反应中属于化合反应的有处;(4)、计算:kg NH4NO3中含有氮元素的质量为14kg。3. 华为公司作为我国高科技的代表,一直致力于核心技术的开发。2019年,华为公司推出了5G商用芯片。制造芯片需要用到高纯硅,工业上利用二氧化硅制备高纯硅的工艺流程如下图:
(1)、转化①中发生的是变化(选填“物理”或“化学”);(2)、请写出转化③处发生反应的化学方程式;(3)、上述化学反应中属于化合反应的有处;(4)、计算:kg NH4NO3中含有氮元素的质量为14kg。3. 华为公司作为我国高科技的代表,一直致力于核心技术的开发。2019年,华为公司推出了5G商用芯片。制造芯片需要用到高纯硅,工业上利用二氧化硅制备高纯硅的工艺流程如下图: (1)、写出CO的任意一点物理性质。(2)、写出反应③的化学方程式。该反应属于(填基本反应类型)反应。(3)、玻璃的主要成分是二氧化硅,二氧化硅属于(填“金属氧化物”或“非金属氧化物”)。二氧化硅(SiO2)与氢氧化钠溶液反应类似于二氧化碳与氢氧化钠溶液的反应。请写出二氧化硅与氢氧化钠溶液反应的化学方程式。(4)、整个制备过程必须在无水、无氧气的环境中进行,原因是。4. 从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
(1)、写出CO的任意一点物理性质。(2)、写出反应③的化学方程式。该反应属于(填基本反应类型)反应。(3)、玻璃的主要成分是二氧化硅,二氧化硅属于(填“金属氧化物”或“非金属氧化物”)。二氧化硅(SiO2)与氢氧化钠溶液反应类似于二氧化碳与氢氧化钠溶液的反应。请写出二氧化硅与氢氧化钠溶液反应的化学方程式。(4)、整个制备过程必须在无水、无氧气的环境中进行,原因是。4. 从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示: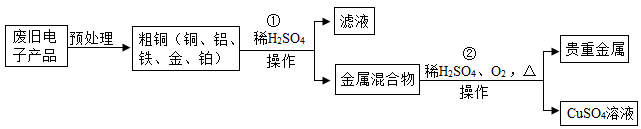 (1)、图中“操作”的名称是 。(2)、写出所得贵重金属中任意一种成分的化学式。(3)、写出①中发生的化学反应方程式(任写一种);该反应的基本类型为 。(4)、写出②中发生的化学反应方程式。5. 工业上利用氟碳铈矿(主要成分为CeFCO3)提取CeCl3的一种工艺流程如下:
(1)、图中“操作”的名称是 。(2)、写出所得贵重金属中任意一种成分的化学式。(3)、写出①中发生的化学反应方程式(任写一种);该反应的基本类型为 。(4)、写出②中发生的化学反应方程式。5. 工业上利用氟碳铈矿(主要成分为CeFCO3)提取CeCl3的一种工艺流程如下: (1)、流程中Ce(BF4)3转化成KBF4的基本反应类型是。(2)、在足量氧气中高温焙烧CeFCO3 , 化学方程式为。(3)、流程涉及的化合物中,铈元素的化合价为价。(4)、酸浸过程中,CeO2与盐酸反应有刺激性气味的气体单质生成,且化学方程式中CeO2与盐酸的化学计量数之比为1:4,则化学方程式为。6. 硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如下图所示。请回答下列问题:
(1)、流程中Ce(BF4)3转化成KBF4的基本反应类型是。(2)、在足量氧气中高温焙烧CeFCO3 , 化学方程式为。(3)、流程涉及的化合物中,铈元素的化合价为价。(4)、酸浸过程中,CeO2与盐酸反应有刺激性气味的气体单质生成,且化学方程式中CeO2与盐酸的化学计量数之比为1:4,则化学方程式为。6. 硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如下图所示。请回答下列问题: (1)、B2O3中B元素的化合价为。(2)、为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是;回收副产物Mg(OH)2可制得流程的反应物。(3)、H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为。(4)、根据流程③的化学反应方程式: ,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?7. 接触法生产硫酸的工艺流程如下:
(1)、B2O3中B元素的化合价为。(2)、为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是;回收副产物Mg(OH)2可制得流程的反应物。(3)、H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为。(4)、根据流程③的化学反应方程式: ,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?7. 接触法生产硫酸的工艺流程如下: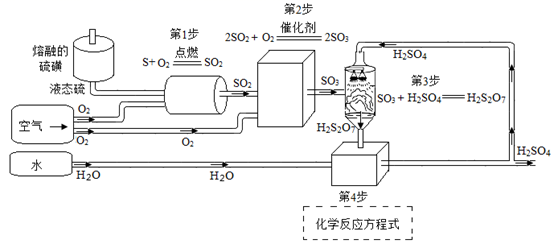
回答下列问题:
(1)、第1步反应中将液态硫喷入反应器的目的是。(2)、写出第4步化学反应方程式。(3)、第1步至第4步流程中涉及到的物质,属于氧化物的有(用化学式表示);(4)、若用3.2吨硫为原料,则理论上能产出98%的浓硫酸吨。8. “84消毒液”在抗击新冠病毒时可作环境消毒剂,其有效成分为次氯酸钠(NaClO)。如图为一种制取“84消毒液”的简化流程:
图中A、B气体均为单质,混合液、Ⅰ、Ⅱ的溶质均为NaOH和NaCl。
回答下列问题:
(1)、B气体是一种新型能源,也可作燃料。与其它燃料相比,其优点有(写一点即可)。(2)、反应①的化学方程式为。(3)、混合液Ⅰ经蒸发浓缩、冷却结晶、后得到混合液Ⅱ和NaCl晶体。(4)、混合液Ⅱ中的NaOH与A气体发生反应②,产生NaClO、NaCl和H2O,该反应的化学方程式为。(5)、“84消毒液”与洁厕灵混用时会产生有毒的Cl2 , 其化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O。对该反应的分析错误的是(填选项序号)。aNaClO、H2O均为氧化物
b不属于任何基本反应类型
c只有氯元素的化合价发生了改变
9. 金属钛常被用于航天、化工、医疗领域,工业上常用钛铁矿制取钛,并获得副产品氧化钛,其工艺流程的部分步骤如图所示: (1)、TiO2中钛元素的化合价为。(2)、在下列反应中,属于分解反应的有___(填标号)。A、反应① B、反应② C、反应③ D、反应④(3)、反应⑤的化学方程式为:2FeSO4 Fe2O3+ SO3↑+X↑,则X的化学式为。10. 金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。(1)、目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、等优点。(2)、镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是(写其中一个化学方程式)。(3)、某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。
(1)、TiO2中钛元素的化合价为。(2)、在下列反应中,属于分解反应的有___(填标号)。A、反应① B、反应② C、反应③ D、反应④(3)、反应⑤的化学方程式为:2FeSO4 Fe2O3+ SO3↑+X↑,则X的化学式为。10. 金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。(1)、目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、等优点。(2)、镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是(写其中一个化学方程式)。(3)、某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。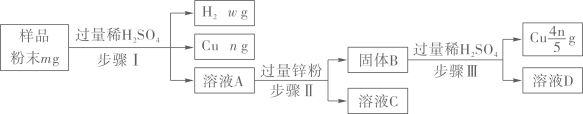
①步骤II的操作是
②步骤II中产生的现象是。步骤I中锌和稀硫酸反应的化学方程式为。
③若溶液C中只含一种溶质,则样品的成分是。
④通过测氢气的质量,也可确定样品的成分,则w的值为(用m和n的代数式表示)。
11. 合理利用化石燃料资源,是人类不断探索的课题。某城市家用燃料的使用经历了下图所示的过程,并将逐步向理想燃料发展。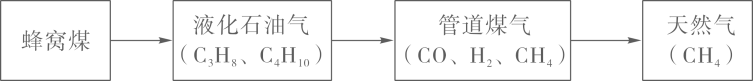
(注:括号中的物质是对应燃料的主要成分)
(1)、CH4、C3H8两种物质中,氢元素的质量分数较大的是(填化学式)。(2)、倡导“家用燃料低碳化”的意义是。(3)、一定条件下,仅用一个置换反应即可制得CO和H2 , 反应的化学方程式为。(4)、随着全球能源使用量的增长,化石燃料等不可再生能源将日趋枯竭。请提出一个缓解能源危机的设想:。12. 下图是某载人飞行器中的空气更新系统。请回答下列问题: (1)、在装置甲中,物质的分子种类(选填“发生”或“不发生”)变化;装置丙中发生反应的过程中,最小的微粒是(填微粒的名称)。(2)、装置乙中的反应需要在高温、高压、催化剂的条件下进行,该反应的化学方程式为。13. 氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿的空气中易变质。CuCl的制备流程如下:
(1)、在装置甲中,物质的分子种类(选填“发生”或“不发生”)变化;装置丙中发生反应的过程中,最小的微粒是(填微粒的名称)。(2)、装置乙中的反应需要在高温、高压、催化剂的条件下进行,该反应的化学方程式为。13. 氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿的空气中易变质。CuCl的制备流程如下: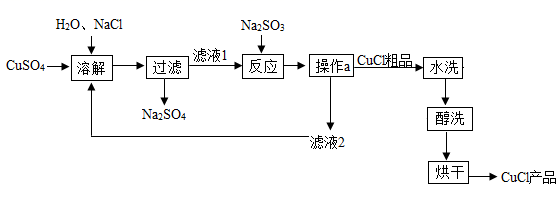 (1)、CuCl中铜元素的化合价是;“操作a”的名称是。(2)、“滤液1”中除了含有Na+、Cl-、SO42-外,还含有较多的离子是。(3)、“反应”中发生反应的化学方程式是 ,产生的X迅速与水化合生成一种酸,该反应的化学方程式为。(4)、本流程中可以循环利用的物质(水除外)是 (填化学式);醇洗的目的是。14. 某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究氯酸钾与二氧化锰的质量比对反应速率的影响。
(1)、CuCl中铜元素的化合价是;“操作a”的名称是。(2)、“滤液1”中除了含有Na+、Cl-、SO42-外,还含有较多的离子是。(3)、“反应”中发生反应的化学方程式是 ,产生的X迅速与水化合生成一种酸,该反应的化学方程式为。(4)、本流程中可以循环利用的物质(水除外)是 (填化学式);醇洗的目的是。14. 某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究氯酸钾与二氧化锰的质量比对反应速率的影响。编号
温度
催化剂
氯酸钾、二氧化锰的质量比
生成1升氧气所需时间/s
实验Ⅰ
400℃
MnO2
1:1
153
实验Ⅱ
400℃
MnO2
2:1
240
(1)、要得出正确的实验结论,除了测量收集1升氧气所需要的时间,还可以测量相同时间内;(2)、小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行了如下探究:(猜想Ⅰ)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(设计实验)
按下表进行实验,并测定开始产生气体时的温度(即分解温度,分解温度越低,表示反应速度越快)。
实验编号
实验药品
分解温度(℃)
①
氯酸钾
580
②
氯酸钾和二氧化锰(质量比1︰1)
350
③
氯酸钾和氧化铜(质量比1︰1)
370
④
氯酸钾和氧化铁(质量比1︰1)
390
(数据和结论)
①由实验与对比,证明猜想合理;
②实验所用的三种物质中,有一种催化效果最好,写出该物质与氯酸钾混合加热的符号表达式。
(3)、(反思)若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的和是否改变。
(4)、小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。(猜想Ⅱ)过氧化钙与水反应可制取氧气。
实验装置
实验主要过程

①检查装置气密性。
②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,振荡试管后仍有少量细小气泡缓慢放出。
实验结论:过氧化钙与水反应(填“能”或“不能”)用于实验室制取氧气。
(5)、(分析与反思)①过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是。
②小林希望对此实验进行改进,使该反应速率加快,请你帮他提出一条合理化建议。
(6)、(计算)该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如下图所示。试计算:

①过氧化钙的相对分子质量为;
②过氧化钙中氧元素与钙元素的质量比为;
③该产品中过氧化钙的质量至少为。
15. 根据已有研究成果表明:全世界每年向大气中排放二氧化碳340亿吨以上,其中海洋生态系统吸收约20亿吨,陆地生态系统吸收约7亿吨,而人工利用量不足10亿吨。在此背景下,实现二氧化碳减排已成为行业共识。国际能源署(IEA)曾表示,要实现升温不超过2℃的目标,碳捕获和利用(CCUS)技术需要在2015-2020年贡献全球碳减排总量的13%。图1是报道的主要CCUS技术的示意图,包括CO2捕获、储存、利用(直接使用)和转化为化学品或燃料。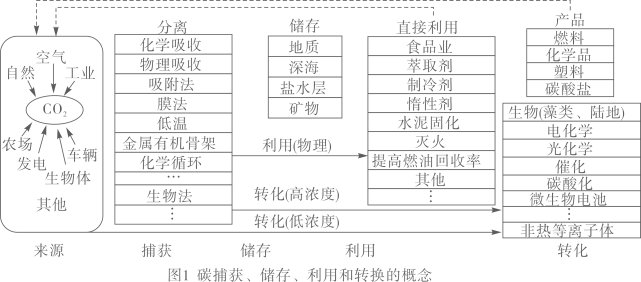
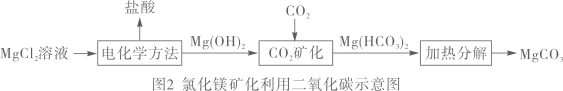
中国科学家提出,利用我国丰富的镁矿资源将CO2吸收转变成重要的化工原料碳酸镁,生产示意图如下:
国内外利用CO2跟氢气在特殊催化剂作用下合成甲醇(CH3OH),同时生成水。
该反应已经在工厂规模化生产,实现减排同时又合成重要化工原料。
请回答下列问题:
(1)、“IEA”的中文含义是。人类活动排放CO2的主要途径有农场、工业(回答一种即可)(2)、为控制空气中CO2的含量,以下建议不可行的是___________(填字母序号)A、开发新能源 B、禁止使用化石燃料 C、大力植树造林 D、发展公共交通 E、以CO2等为原料,生产碳酸镁、甲醇等产品(3)、写出图2中“CO2矿化”的化学方程式。(4)、利用CO2合成甲醇(CH3OH)的化学方程式。