初中化学九年级下册第十单元单元检测卷
试卷更新日期:2020-12-28 类型:单元试卷
一、单选题
-
1. 下列常见物质显碱性的是( )A、食醋 B、食盐水 C、肥皂水 D、柠檬水2. 下列关于酸、碱的说法错误的是( )A、苛性钠、烧碱、火碱都是氢氧化钠 B、氢氧化钙可以用来改良酸性土壤 C、稀盐酸能够使酚酞溶液变红 D、生活中许多常见的物质(如柠檬、柑橘)中含有酸3. 正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )A、测定溶液pH
 B、配制溶液
B、配制溶液  C、称量固体质量
C、称量固体质量  D、稀释浓硫酸
D、稀释浓硫酸  4. 归纳推理是学习化学的一种重要的思维方法,下列归纳推理正确的是( )A、化合物是由多种元素组成的,则由多种元素组成的物质一定是化合物 B、锌粒和稀硫酸反应会产生氢气,则所以金属都能和稀硫酸反应产生氢气 C、置换反应有单质生成,则有单质生成的反应一定是置换反应 D、常温下,pH大于7的溶液呈碱性,则碱性溶液的pH一定大于75. 家庭中一些常见物质的pH如下表所示:
4. 归纳推理是学习化学的一种重要的思维方法,下列归纳推理正确的是( )A、化合物是由多种元素组成的,则由多种元素组成的物质一定是化合物 B、锌粒和稀硫酸反应会产生氢气,则所以金属都能和稀硫酸反应产生氢气 C、置换反应有单质生成,则有单质生成的反应一定是置换反应 D、常温下,pH大于7的溶液呈碱性,则碱性溶液的pH一定大于75. 家庭中一些常见物质的pH如下表所示:物质
食醋
酱油
食盐水
牙膏
肥皂
pH
2~3
4~5
7
8~9
9~10
夏天我们被蚊虫叮咬后,蚊虫会在人的皮肤内分泌蚁酸(一种酸),从而使皮肤肿痛。要减轻痛痒,可在叮咬处涂抹下列物质中的( )
A、食醋 B、酱油 C、肥皂水 D、食盐水6. 某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )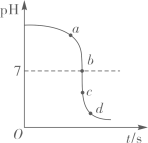 A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应7. 图像能直观体现化学中的各种变化关系,加深对化学知识的理解。下列图像不能正确反映对应关系的是( )A、
A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应7. 图像能直观体现化学中的各种变化关系,加深对化学知识的理解。下列图像不能正确反映对应关系的是( )A、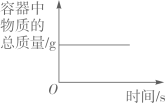 在密闭的容器中加热汞得到氧化汞
B、
在密闭的容器中加热汞得到氧化汞
B、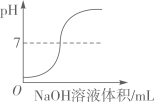 向一定量的稀盐酸中滴加氢氧化钠溶液
C、
向一定量的稀盐酸中滴加氢氧化钠溶液
C、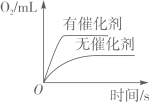 两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
D、
两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
D、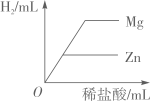 向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
8. 下列能使紫色石蕊试液和无色酚酞试液均变色的是( )A、pH=1的盐酸 B、pH=3的硫酸 C、pH=7的氯化钠溶液 D、pH=14的氢氧化钾溶液9. 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸。下列图像能正确反映其对应变化关系的是( )A、
向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
8. 下列能使紫色石蕊试液和无色酚酞试液均变色的是( )A、pH=1的盐酸 B、pH=3的硫酸 C、pH=7的氯化钠溶液 D、pH=14的氢氧化钾溶液9. 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸。下列图像能正确反映其对应变化关系的是( )A、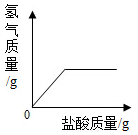 B、
B、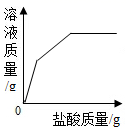 C、
C、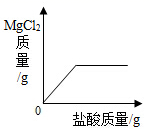 D、
D、 10. 如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
10. 如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )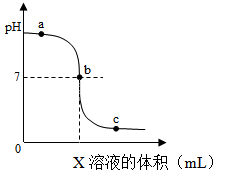 A、图中X是氢氧化钠 B、图中a点的阴离子是OH- C、向图中c点所示溶液中加入铁粉后,溶液中有气泡产生 D、稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O11. 下列物质间不能发生反应的是( )A、稀盐酸和镁条 B、稀盐酸和铜丝 C、稀盐酸和氢氧化镁 D、稀盐酸和氢氧化铜12. 20gKOH加入100g水中,配制成溶液。下列说法错误的是( )A、KOH在水中解离出K+和OH- B、一个K+带一个单位正电荷 C、该溶液的溶质质量分数为20% D、向该溶液中滴入酚酞指示剂,溶液变红13. 饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )A、氢氧化铝 B、氯化钠 C、碳酸镁 D、碳酸氢钠14. 硫酸是一种重要的工业原料,下列说法错误的是( )A、浓硫酸可用于干燥O2 B、浓硫酸可使纸张炭化 C、实验室可用块状石灰石与稀硫酸制备CO2 D、稀硫酸可用于金属表面除锈15. 按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A、图中X是氢氧化钠 B、图中a点的阴离子是OH- C、向图中c点所示溶液中加入铁粉后,溶液中有气泡产生 D、稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O11. 下列物质间不能发生反应的是( )A、稀盐酸和镁条 B、稀盐酸和铜丝 C、稀盐酸和氢氧化镁 D、稀盐酸和氢氧化铜12. 20gKOH加入100g水中,配制成溶液。下列说法错误的是( )A、KOH在水中解离出K+和OH- B、一个K+带一个单位正电荷 C、该溶液的溶质质量分数为20% D、向该溶液中滴入酚酞指示剂,溶液变红13. 饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )A、氢氧化铝 B、氯化钠 C、碳酸镁 D、碳酸氢钠14. 硫酸是一种重要的工业原料,下列说法错误的是( )A、浓硫酸可用于干燥O2 B、浓硫酸可使纸张炭化 C、实验室可用块状石灰石与稀硫酸制备CO2 D、稀硫酸可用于金属表面除锈15. 按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )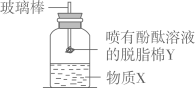 A、浓盐酸 B、浓氨水 C、浓醋酸 D、浓氢氧化钠溶液
A、浓盐酸 B、浓氨水 C、浓醋酸 D、浓氢氧化钠溶液二、填空题
-
16. 盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。(1)、用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为g,所需浓盐酸的质量为g。
②已知浓盐酸密度为1.19g/cm3 , 量取上述所需浓盐酸用到的仪器是(填标号)。
A、10mL量筒
B、50mL量筒
C、试管
D、胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在上。
(2)、取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是。(3)、取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。①铁与稀盐酸反应的化学方程式为。
②下列示意图中,与实验结果相符的是(填标号)。
 17. 宏观辨识和微观探析是化学核心素养之一。根据下列微观示意图回答。
17. 宏观辨识和微观探析是化学核心素养之一。根据下列微观示意图回答。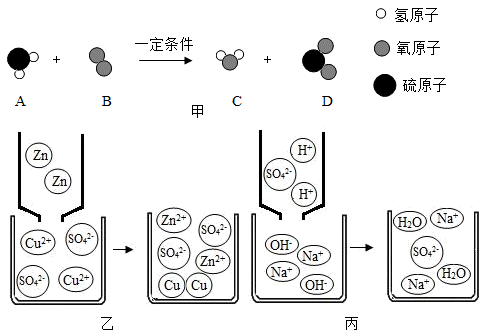 (1)、如图甲所示,物质A由元素组成,一个D分子由构成。(2)、图乙是锌粒与硫酸铜溶液恰好完全反应的微观示意图,写出反应后溶液中所有粒子的符号 , 该反应属于(填基本反应类型)。(3)、从微观的角度说明图丙的反应实质是。若想证明两种物质是否恰好完全反应,可在反应后的溶液中加入适量的试剂,该试剂是(填序号)。
(1)、如图甲所示,物质A由元素组成,一个D分子由构成。(2)、图乙是锌粒与硫酸铜溶液恰好完全反应的微观示意图,写出反应后溶液中所有粒子的符号 , 该反应属于(填基本反应类型)。(3)、从微观的角度说明图丙的反应实质是。若想证明两种物质是否恰好完全反应,可在反应后的溶液中加入适量的试剂,该试剂是(填序号)。A、BaCl2溶液
B、酚酞溶液
C、石蕊溶液
D、Na2CO3溶液
三、实验探究题
-
18. 酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。(1)、(实验探究Ⅰ)在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 , 由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
(2)、由图可知,盐酸、氢氧化钠溶液稀释时均(填“放热”或“吸热”),但它们稀释时温度的变化量远两溶液混合时温度的变化量。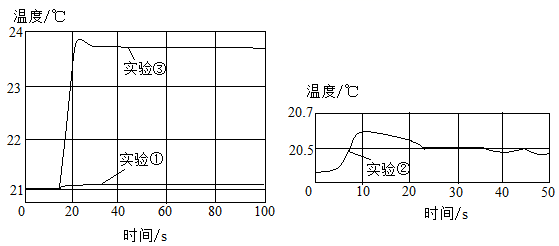 (3)、从微观角度分析,此中和反应的温度变化主要是由于(填离子符号)两种离子发生反应放出热量的缘故。(4)、(实验探究Ⅱ)
(3)、从微观角度分析,此中和反应的温度变化主要是由于(填离子符号)两种离子发生反应放出热量的缘故。(4)、(实验探究Ⅱ)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为。
(5)、取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想是错误的,理由是。
实验验证:取样,滴加 , 无气泡产生,猜想三不正确。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色(填“一定”或“不一定”)变红。
19. 实验室可利用Zn与稀硫酸的反应制取H2。(1)、用浓硫酸配制稀硫酸的操作为________(填字母),用玻璃棒引流,并不断搅拌。A、将浓硫酸缓缓注入盛有水的烧杯中 B、水缓缓注入盛有浓硫酸的烧杯中(2)、Zn与稀硫酸反应的化学方程式为。(3)、图-1所示的仪器B、D的名称为、 , 组装制取H2的发生装置应选用的仪器为(填字母)。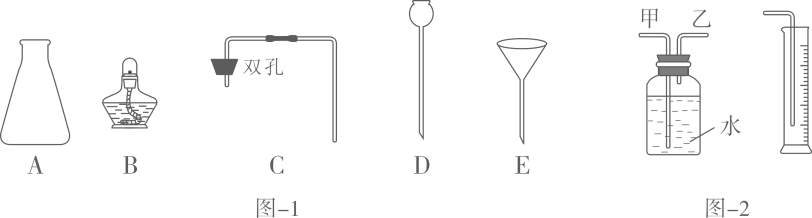 (4)、为收集并准确测量H2的体积,在装入药品前,需检查装置的。(5)、相同条件下H2密度比空气小,利用该性质可以通过法收集H2 , 若用图-2所示装置测量生成H2的体积,H2应从(填“甲”或“乙”)管通入。(6)、为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常状况)所需的时间,下表为实验数据:
(4)、为收集并准确测量H2的体积,在装入药品前,需检查装置的。(5)、相同条件下H2密度比空气小,利用该性质可以通过法收集H2 , 若用图-2所示装置测量生成H2的体积,H2应从(填“甲”或“乙”)管通入。(6)、为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常状况)所需的时间,下表为实验数据:实验编号
硫酸的质量分数/%
硫酸的体积/mL
锌粒的质量/g
时间/s
1
10
10
1
78
2
10
10
2
57
3
40
10
1
9
①比较实验1、2的数据,可以得出的结论是。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是(写出一种)。
四、综合题
-
20. 氯化钡是一种可溶性重金属盐,广泛应用于化工领域。工业上以重晶石(主要成分BaSO4 , 杂质为Fe2O3)为原料,通过下列流程生成氯化钡晶体。
已知:①BaSO4+4C 4CO↑+BaS,②CaO、BaO都能与水反应生成碱
 (1)、焙烧时,焦炭与杂质Fe2O3也会发生反应;此过程中焦炭用途除了与BaSO4、Fe2O3反应外,还有。焙烧时,温度对硫酸钡转化率的影响如右图,则最佳温度约为。
(1)、焙烧时,焦炭与杂质Fe2O3也会发生反应;此过程中焦炭用途除了与BaSO4、Fe2O3反应外,还有。焙烧时,温度对硫酸钡转化率的影响如右图,则最佳温度约为。 (2)、酸溶时,硫化钡(BaS)与盐酸发生复分解反应产生硫化氢气体(H2S),该反应方程式为 , 气体X成分除H2S和少量挥发出的HCl、水蒸气外,还含有。(3)、除铁反应中试剂Y可以是(填字母)
(2)、酸溶时,硫化钡(BaS)与盐酸发生复分解反应产生硫化氢气体(H2S),该反应方程式为 , 气体X成分除H2S和少量挥发出的HCl、水蒸气外,还含有。(3)、除铁反应中试剂Y可以是(填字母)a.NaOH溶液 b.生石灰 c.Ba(OH)2溶液 d.BaO固体
证明铁已除尽的方法是:取少量上层清液于试管中,滴入足量溶液,若观察到 , 则已除尽。
五、计算题
-
21. 将含有NaCl杂质的某烧碱样品10g完全溶于90g水中,再向所得溶液中慢慢滴入溶质质量分数为7.3%的稀盐酸。在实验过程中,溶液的pH与滴入稀盐酸的质量关系如图所示。
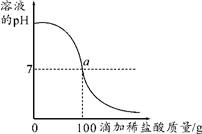
(1)、求10g该样品中氢氧化钠的质量。(2)、求a点时,溶液中溶质的质量分数(计算结果精确到0.1%)。
-