初中化学人教版九年级下册第十单元课题1常见的酸和碱
试卷更新日期:2020-12-28 类型:同步测试
一、单选题
-
1. 化学是一门以实验为基础的自然科学。下列实验操作正确的是( )A、固体NaCl的称量
 B、吸取液体药品
B、吸取液体药品  C、放置一瓶集满二氧化碳的集气瓶
C、放置一瓶集满二氧化碳的集气瓶  D、浓硫酸的稀释
D、浓硫酸的稀释 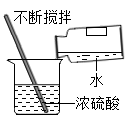 2. 下列物质露置在空气中,质量会减少的是( )A、生石灰 B、苛性钠 C、浓硫酸 D、浓盐酸3. 推理是学习化学常用的思维方法,下列推理正确的是( )A、燃烧都伴有发光、放热现象,所以有发光、放热现象的一定是燃烧 B、单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质 C、酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的溶液一定是酸溶液 D、溶液一定是混合物,所以混合物一定是溶液4. 下列说法正确的是( )A、不同种元素最本质的区别是相对原子质量的不同 B、空气质量指数级别越高,空气质量越差 C、饱和澄清石灰水变浑浊一定是发生了化学变化 D、敞口放置一段时间的浓盐酸和浓硫酸,溶质的质量分数和溶液的质量都会减小5. 下列推理合理的是( )A、单质中只含一种元素,但是只含一种元素的物质不一定是单质 B、因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 C、置换反应中一定有单质生成,则有单质生成的化学反应一定是置换反应 D、因为碱溶液呈碱性,所以显碱性的溶液一定都是碱的溶液6. 如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是( )
2. 下列物质露置在空气中,质量会减少的是( )A、生石灰 B、苛性钠 C、浓硫酸 D、浓盐酸3. 推理是学习化学常用的思维方法,下列推理正确的是( )A、燃烧都伴有发光、放热现象,所以有发光、放热现象的一定是燃烧 B、单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质 C、酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的溶液一定是酸溶液 D、溶液一定是混合物,所以混合物一定是溶液4. 下列说法正确的是( )A、不同种元素最本质的区别是相对原子质量的不同 B、空气质量指数级别越高,空气质量越差 C、饱和澄清石灰水变浑浊一定是发生了化学变化 D、敞口放置一段时间的浓盐酸和浓硫酸,溶质的质量分数和溶液的质量都会减小5. 下列推理合理的是( )A、单质中只含一种元素,但是只含一种元素的物质不一定是单质 B、因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 C、置换反应中一定有单质生成,则有单质生成的化学反应一定是置换反应 D、因为碱溶液呈碱性,所以显碱性的溶液一定都是碱的溶液6. 如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是( )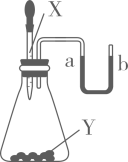 A、水、硝酸铵 B、水、烧碱 C、稀硫酸、铁粉 D、稀盐酸、小苏打7. A~F为初中化学常见物质,固体A在空气中易潮解,B和C能参与光合作用,B和D组成元素相同。它们相互转化的关系如图所示(“→”表示反应能一步实现,“一”表示相连物质间能发生反应,部分反应物、生成物和反应条件已省略)。下列说法错误的是( )
A、水、硝酸铵 B、水、烧碱 C、稀硫酸、铁粉 D、稀盐酸、小苏打7. A~F为初中化学常见物质,固体A在空气中易潮解,B和C能参与光合作用,B和D组成元素相同。它们相互转化的关系如图所示(“→”表示反应能一步实现,“一”表示相连物质间能发生反应,部分反应物、生成物和反应条件已省略)。下列说法错误的是( )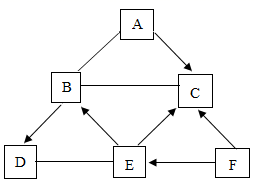 A、C和F组成元素可能相同 B、固体B可用于人工降雨 C、D和E在一定条件下反应生成B D、A~F属于酸、碱、盐、氧化物、单质中的四类物质
A、C和F组成元素可能相同 B、固体B可用于人工降雨 C、D和E在一定条件下反应生成B D、A~F属于酸、碱、盐、氧化物、单质中的四类物质二、实验探究题
-
8. 某同学取一块表面完全锈蚀的生铁片进行了以下探究:(1)、实验:
步骤
操作
现象
结论
①
取适量固体于试管中加热,用一干冷的玻片置于试管口上方
固体中含有水
②
取适量固体于试管中,加入足量的稀盐酸,观察溶液颜色
溶液呈黄色
固体中含有Fe2O3
③
收集步骤②试管中产生的气体,
有爆鸣声
固体中含有
④
将上面反应后的混合液过滤
有黑色固体
黑色固体的主要成
分是
(2)、表达:写出步骤②反应的一个化学方程式:。(3)、拓展:取2枚未生锈的铁钉,一枚部分浸入蒸馏水,另一枚部分浸入盐水,生锈较快的是 , 铁生锈是铁和氧气和反应的结果。9. 某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们进行了以下探究:(1)、(提出问题)氢氧化钠溶液是否变质?变质程度如何?(做出猜想)猜想一:氢氧化钠溶液未变质
猜想二:氢氧化钠溶液完全变质
猜想三:。
(2)、(设计实验)请完成实验报告实验步骤
实验现象
实验结论
①取少量溶液于试管中,加入 , 充分反应。
猜想二成立
②将步骤①试管中的物质过滤,向滤液中加入。
无明显现象
(3)、(反思拓展)①氢氧化钠溶液变质的原因(用化学方程式表示),氢氧化钠溶液应保存。
②分别取两份完全变质的氢氧化钠溶液样品于试管中,向其中一份加入盐酸有气泡产生,另一份加入氢氧化钙溶液有白色沉淀产生,然后将两支试管中所有物质一起倒入废液缸中,得到无色澄清溶液,所得溶液中溶质一定有。

三、推断题
-
10. A~F是初中化学常见物质。A是生命之源,是人体中含量最多的物质;B与A发生化合反应生成C,C俗称熟石灰;D是由三种非金属元素组成的盐,D和A混合,溶液温度显著降低,据此原理可制作“摇摇冰”;C与D混合加热反应生成A、E、F三种物质,E为有刺激性气味的气体。请回答下列问题:(1)、A的化学式为;电解A的实验,正、负极产生的气体体积比为。(2)、B俗称 , B与A反应的化学方程式为。(3)、C的澄清溶液通常用来检验气体。(4)、D在农业上可用作肥。(5)、E能使湿润的红色石蕊试纸变色。(6)、C与D混合加热反应的化学方程式为。
四、综合题
-
11. 硫酸和盐酸是两种重要的化工原料。(1)、浓硫酸常用作干燥剂因为它具有 , 浓盐酸因为有而要密封保存。(2)、写出稀硫酸与下类物质反应的化学方程式。
①和镁条的反应:。
②和碳酸钠溶液反应:。
③和氯化钡溶液反应:。
上述反应中属于复分解反应的有;属于酸的共同性质的有 (填编号);不同的酸性质差异的原因。
(3)、盐酸的下列用途中,不能用硫酸代替盐酸的是。(填编号)①金属表面除锈 ②制造药物氯化锌 ③除去氯化钠中的少量碳酸钠
(4)、某实验小组探究酸的化学性质,在做盐酸除铁锈的试验时发现:铁锈的主要成分是 , 为除去铁钉上的锈迹,某学生将带锈迹的铁钉放入过量的盐酸中,他首先看到锈迹溶解,溶液呈色。这是因为(用化学方程式表示);不一会儿,又看到溶液中有的现象,这是因为铁钉部分溶解(用化学方程式表示)。12. 如图是五种日常生活中常用的化工产品。请回答下列问题: (1)、彩漂液(图1)的有效成分为过氧化氢,长期存放会失效,用化学方程式解释失效的原因。(2)、洁厕灵(图2)含有盐酸,盐酸中的阴离子是(填符号),洁厕灵与“84”消毒液(图3)混合会发生如下反应:2HCl+NaClO=X+H2O+Cl2↑,对人体造成伤害。下列说法正确的是(填字母序号)。
(1)、彩漂液(图1)的有效成分为过氧化氢,长期存放会失效,用化学方程式解释失效的原因。(2)、洁厕灵(图2)含有盐酸,盐酸中的阴离子是(填符号),洁厕灵与“84”消毒液(图3)混合会发生如下反应:2HCl+NaClO=X+H2O+Cl2↑,对人体造成伤害。下列说法正确的是(填字母序号)。A 、X的化学式为NaCl B 、将酚酞试液滴入洁厕灵中变红色
C 、洁厕灵能用于清除水垢 D、 NaClO中氯的化合价为+1
(3)、洗发水(图4)洗掉头发分泌的油脂,其原理是(填“乳化”或“溶解”)作用。(4)、还原铁粉常用于食品包装中(图5),使用一段时间后发现铁粉部分变为红色(Fe2O3),取粉末少许滴入稀盐酸,发生反应的化学方程式为、。13. A、B、C均为初中阶段常见的物质, A可用做照明弹,B为浅绿色溶液,C是一种含钠元素的化合物并与稀盐酸反应产生气泡。如图,用圆圈表示这五种物质,用“一”表示两种物质可以反应,用“→”表示一种物质可以转化为另一种物质。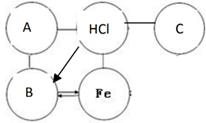 (1)、请在图中标出A,B, C三种物质或溶液中溶质的化学式;(2)、请写出Fe转化为B的化学方程式;(3)、A与过量稀盐酸反应的现象 。14. 浓硫酸是一种无色黏稠的油状液体,具有很强的腐蚀性。
(1)、请在图中标出A,B, C三种物质或溶液中溶质的化学式;(2)、请写出Fe转化为B的化学方程式;(3)、A与过量稀盐酸反应的现象 。14. 浓硫酸是一种无色黏稠的油状液体,具有很强的腐蚀性。
(1)、实验室有一敞口放置的浓硫酸,其质量分数会 ,是因为 。
(2)、将10克98%的浓硫酸稀释成19.6%的稀硫酸,需加水 克;配置过程中用到的三种玻璃仪器为 。(3)、将一颗生锈铁钉加入稀盐酸,开始看到的现象是 , 反应方程式为。盐酸不宜过量是因为(方程式表示)。
15. 正确的操作是实验成功的保证。(1)、如图甲所示,实验室稀释浓硫酸时,①处的试剂是(填字母序号),用玻璃棒不断搅拌的作用是(填字母序号)。
A 浓硫酸
B 水
C 引流
D 防止局部温度过高,造成酸液飞溅
(2)、实验室配制一定溶质质量分数的氯化钠溶液的操作过程如图乙所示,正确的操作顺序是(填字母序号)。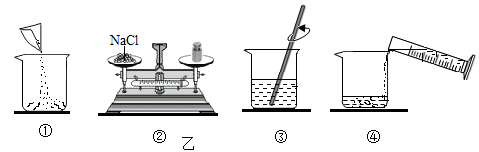
A ①②③④
B ②①④③
C ②①③④
五、计算题
-
16. 为测定某大理石样品(杂质不溶于水也不与稀盐酸反应)中碳酸钙的含量,某中学化学兴趣小组的同学取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应,称得反应后烧杯中剩余物质的总质量为107.6g(产生的气体全部逸出),试计算:(1)、反应生成二氧化碳的质量是多少克?(2)、大理石样品中碳酸钙的质量分数。(计算结果精确到0.1%)(3)、所用稀盐酸的溶质质量分数。(4)、反应后所得溶液的溶质质量分数。(计算结果精确到0.1%)
-