浙江省绍兴市新昌县2020-2021学年九年级上学期科学期中考试试卷(到第2章结束)
试卷更新日期:2020-12-21 类型:期中考试
一、选择题(本题有15小题,每小题4分,共60分,请选出一个符合题意的正确选项,不选、多选、错选均不给分)
-
1. 下列实验室中的交流,属于化学变化的是( )A、酒精灯:“帽子哪里去了?我的燃料越来越少了” B、胶头滴管:“谁做的?我的嘴怎么碰碎到试管里面去了?” C、锥形瓶:“同学们不爱惜我,我被摔碎了” D、铁架台:“好难受啊!我在潮湿的空气中生锈了”2. 化学是初中阶段的科学中非常重要的一门学科,我们身边的很多现象都能用某些化学原理来解释。下列有关的化学概念和现象描述错误的是( )A、pH是反映物质酸碱性强弱的指标,它的范围通常在0-14之间 B、如果我们的环境没有任何污染,那么雨水的pH应该是7 C、浓硫酸的稀释实验中,不把水倒入浓硫酸的的原因之一是浓硫酸溶于水会放出大量热。 D、向氢氧化钠溶液中边滴加盐酸边震荡,目的是为了使两者充分反应。3. 测定人体内体液的pH,可以帮助人们了解身体的健康状况,一些体液的近似pH如下:
下列液体中,碱性最强的是( )
液体
胃液
胰液
胆汁
血浆
PH
0.9-1.5
7.5-8.0
7.1-7.3
7.35-7.45
A、胰液 B、胃液 C、胆汁 D、血浆4. 下列实验方法不能达到目的的是( )
A、用燃烧的方法区分棉花和羊毛 B、用带火星的木条鉴别氧气和氮气 C、用氢氧化钙检验铵态氮肥 D、用稀盐酸除去铁粉中混有的少量铜粉5. 科学知识与生产生活联系紧密.下列物质用途错误的是( )选项
A
B
C
D
物质
氯化钠
二氧化碳
浓硫酸
氢气
用途
除铁锈
作气体肥料
作干燥剂
作燃料
A、A B、B C、C D、D6. 在许多实验中能看到明显的现象,下列实验现象描述正确的是( )A、铁锈与稀盐酸反应溶液变成浅绿色 B、氢氧化钠溶液中加入硫酸铜溶液,产生蓝色沉淀 C、打开盛有浓盐酸的试剂瓶的瓶盖,瓶口出现白烟 D、将氧化铜加入稀硫酸中,产生气泡同时溶液变蓝色7.物质王国发生了一起团伙盗窃案,“警察”把三名“嫌疑犯”(分别是稀硫酸、氯化钠溶液和石灰水,见图)带回了“警察局”。上级派出下列四名“警察”分别去审问“他们”(即把“他们”鉴别出来)。无法完成任务的“警察”是( )
 A、紫色石蕊试液警察
A、紫色石蕊试液警察 B、稀盐酸警察
B、稀盐酸警察 C、无色酚酞试液警察
C、无色酚酞试液警察 D、纯碱溶液警察
D、纯碱溶液警察 8. 水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )
8. 水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )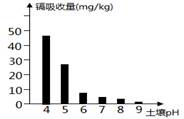 A、熟石灰 B、硫酸铜 C、稀盐酸 D、氯化钠9. 化学用语是世界通用的化学语言,是化学学习的重要工具。下列物质的俗名与化学式一致的是( )A、食盐NaCl B、苛性钠NaHCO3 C、纯碱Ba(OH)2 D、熟石灰CaCO310. 下列关于H2SO4性质描述中,不属于酸的通性的是( )A、使紫色石蕊溶液变红 B、与NaOH发生中和反应 C、浓硫酸滴到白纸上使纸变黑 D、与Mg反应放出氢气11. 下列属于置换反应的是( )A、2H2+O2 = 2H2O B、NaOH+HCl=NaCl+H2O C、2H2O2=2H2O+O2↑ D、Fe+CuCl2=Cu+FeCl212. 实验废液中可能含有离子K+、Mg2+、Cl-、Ba2+、SO42-、CO32-中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:
A、熟石灰 B、硫酸铜 C、稀盐酸 D、氯化钠9. 化学用语是世界通用的化学语言,是化学学习的重要工具。下列物质的俗名与化学式一致的是( )A、食盐NaCl B、苛性钠NaHCO3 C、纯碱Ba(OH)2 D、熟石灰CaCO310. 下列关于H2SO4性质描述中,不属于酸的通性的是( )A、使紫色石蕊溶液变红 B、与NaOH发生中和反应 C、浓硫酸滴到白纸上使纸变黑 D、与Mg反应放出氢气11. 下列属于置换反应的是( )A、2H2+O2 = 2H2O B、NaOH+HCl=NaCl+H2O C、2H2O2=2H2O+O2↑ D、Fe+CuCl2=Cu+FeCl212. 实验废液中可能含有离子K+、Mg2+、Cl-、Ba2+、SO42-、CO32-中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;
②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解,
分析上面实验得出的结论中,正确的是( )
A、只含有Mg2+、SO42- B、一定含有K+、Mg2+、Cl-、SO42- C、一定含有Mg2+、SO42- , 可能含有Cl-、K+ D、一定含有Cl-、K+ , 可能含有Mg2+、SO42-13. 某同学在学习了金属及其化合物之间的转化规律后,绘制了可以通过一步反应制MgCl2的思维导图,其中所选用的物质错误的是( ) A、①—Mg B、②—CuCl2 C、③—HCl D、④—Mg(OH)214. 某同学为验证“分子是运动的”,设计了甲、乙、丙、丁四个实验。能达到目的是( )
A、①—Mg B、②—CuCl2 C、③—HCl D、④—Mg(OH)214. 某同学为验证“分子是运动的”,设计了甲、乙、丙、丁四个实验。能达到目的是( )
 A、甲、乙、丙 B、甲、乙、丁 C、甲、丙、丁 D、乙、丙、丁15. 如图所示,广口瓶中盛有气体X胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡,一段时间后可见小气球a膨胀鼓起.下表中各组物质不出现上述现象的是( )
A、甲、乙、丙 B、甲、乙、丁 C、甲、丙、丁 D、乙、丙、丁15. 如图所示,广口瓶中盛有气体X胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡,一段时间后可见小气球a膨胀鼓起.下表中各组物质不出现上述现象的是( )
X
Y
A
CO
Ca(OH)2
B
CO2
NaOH
C
HCl
Ba(OH)2
D
SO2
NaOH
A、A B、B C、C D、D二、填空题(本题有8小题,21空格,每空格2分,共42分)
-
16. 某植物的花瓣汁液(以下简称:X汁液)呈紫色,X汁液分别滴加到盛有下列溶液的试管中有如下现象:
溶液名称
白醋
稀盐酸
氯化钠溶液
蒸馏水
石灰水
氢氧化钾溶液
X汁液
红色
红色
紫色
紫色
绿色
绿色
(1)、据上表推测,X汁液(填“能”或“不能”)做酸碱指示剂;(2)、将X汁液滴入肥皂水中溶液呈绿色,则肥皂水pH(填“>”、“<”或“=”)7。17. 利用如图所示的实验探究稀酸M的性质。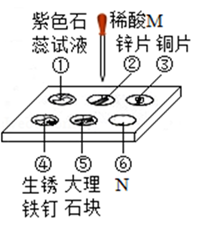 (1)、物质N属于(填“酸、碱、盐、氧化物”)(2)、若②处有气泡、③处无现象,则可判断锌的金属活动性铜(填“大于、小于”)(3)、若①②④⑤处有明显现象,则M可能为。18. 有下列几种物质:A.盐酸 B.熟石灰 C.纯碱 D.食盐;请选择合适的标号(A~D)填空。(1)、少量存于胃液中帮助消化的是。(2)、常用来降低土壤酸性的是;19.
(1)、物质N属于(填“酸、碱、盐、氧化物”)(2)、若②处有气泡、③处无现象,则可判断锌的金属活动性铜(填“大于、小于”)(3)、若①②④⑤处有明显现象,则M可能为。18. 有下列几种物质:A.盐酸 B.熟石灰 C.纯碱 D.食盐;请选择合适的标号(A~D)填空。(1)、少量存于胃液中帮助消化的是。(2)、常用来降低土壤酸性的是;19.物质的结构决定性质,性质反映结构,据此回答.
 (1)、稀盐酸(HCl)和稀硫酸(H2SO4)具有相似的化学性质,原因是它们在电离时都产生了 .(2)、稀盐酸和稀硫酸都是无色透明的液体,为鉴别它们,小柯设计了如图四种方案(每种方案的两支试管中事先分别加入等量的上述两种酸),其中可行的方案有 .20. 将一根生锈的铁钉插入足量的稀硫酸中,首先看到 , 反应方程式为 , 一段时间后,又看到铁钉表面出现,反应的方程式为。21. 如图是“盖房子”的游戏示意图,其规则是根据“上下相邻两层的物质之间均可发生化学反应”来堆砌楼层。图中已放置好四种物质,还有二氧化碳、碳酸钠溶液、硫酸铜溶液三种物质待放置。请回答:二氧化碳应放在处(填序号), 物质②与上下相邻两层物质之间的反应类型都属于反应。
(1)、稀盐酸(HCl)和稀硫酸(H2SO4)具有相似的化学性质,原因是它们在电离时都产生了 .(2)、稀盐酸和稀硫酸都是无色透明的液体,为鉴别它们,小柯设计了如图四种方案(每种方案的两支试管中事先分别加入等量的上述两种酸),其中可行的方案有 .20. 将一根生锈的铁钉插入足量的稀硫酸中,首先看到 , 反应方程式为 , 一段时间后,又看到铁钉表面出现,反应的方程式为。21. 如图是“盖房子”的游戏示意图,其规则是根据“上下相邻两层的物质之间均可发生化学反应”来堆砌楼层。图中已放置好四种物质,还有二氧化碳、碳酸钠溶液、硫酸铜溶液三种物质待放置。请回答:二氧化碳应放在处(填序号), 物质②与上下相邻两层物质之间的反应类型都属于反应。 22. 某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计了如图实验。
22. 某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计了如图实验。 (1)、溶液B中所含的溶质是;(2)、II中加入过量的稀硫酸的目的是除去铜粉中混有的。23. 实验室有一瓶标签残缺(如图)的试剂,老师告诉小明,这瓶试剂是氢氧化钠、氯化钠、硝酸钠、碳酸钠溶液中的一种。为确定该试剂成分,小明进行如下系列实验。
(1)、溶液B中所含的溶质是;(2)、II中加入过量的稀硫酸的目的是除去铜粉中混有的。23. 实验室有一瓶标签残缺(如图)的试剂,老师告诉小明,这瓶试剂是氢氧化钠、氯化钠、硝酸钠、碳酸钠溶液中的一种。为确定该试剂成分,小明进行如下系列实验。取2毫升该试剂于试管中,滴入无色酚酞试液,发现溶液不变色。则推断该试剂不可能是溶液。

再取2毫升该试剂于试管中,滴入A溶液后,根据现象,小明确定该试剂是氯化钠溶液。则A溶液是溶液。
24. 某无色溶液中可能含有Na+ , H+ , Cl- 和SO42- , 现在想要检测两种阴离子是否存在,请你帮助完成实验:(1)、取适量溶液,先向其中滴加足量的溶液,若有白色沉淀生成,则证明有SO2-存在;(2)、再取上层清液加溶液,又出现白色沉淀,则可证明有Cl-存在。三、实验探究题(本题15空格,每空格3分,共45分)
-
25. 敞口放置的氢氧化钾溶液易吸收空气中的二氧化碳而变质,请写出此过程的化学方程式:。现向一定质量且部分变质的氢氧化钾溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。那么,图线AB段对应的实验现象是 , C点溶液中的溶质是。
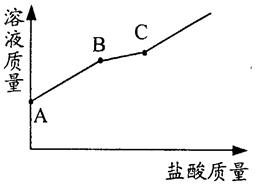 26. 盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
26. 盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。增大压强,HCl由气态变为液态,从微观的角度分析该变化过程中改变的是。盐酸所属的物质类别是 ;(填“有机物”或“无机物”)下列物质能与盐酸反应的是:
A.铁锈 B.水垢 C.硝酸钾 D.苛性钠
在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是。
②下图表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号):

 代表;
代表; 代表。27. 现有四瓶固体药品,标签上贴着A、B、C、D的编号,已知每瓶中放有硫酸铜、碳酸钠、硝酸钾和氯化钠中的某一种物质,各取少量,放在四支试管中,分别加入水后,A溶液呈蓝色 ;再在另三支试管中分别加入盐酸 ,发现B溶液中产生气泡;另取两只试管分别加入C和D瓶中的物质,加水溶解后滴入硝酸银溶液,发现C溶液中出现白色沉淀。根据上述实验现象,请判断并写出4瓶药品的物质名称
代表。27. 现有四瓶固体药品,标签上贴着A、B、C、D的编号,已知每瓶中放有硫酸铜、碳酸钠、硝酸钾和氯化钠中的某一种物质,各取少量,放在四支试管中,分别加入水后,A溶液呈蓝色 ;再在另三支试管中分别加入盐酸 ,发现B溶液中产生气泡;另取两只试管分别加入C和D瓶中的物质,加水溶解后滴入硝酸银溶液,发现C溶液中出现白色沉淀。根据上述实验现象,请判断并写出4瓶药品的物质名称A BC D
28. 氢气还原氧化铜的实验装置如图所示. (1)、如果要还原得到6.4克铜,则理论上需要消耗0.2克氢气,但实际消耗的氢气质量一定 大于理论值,造成这一结果最主要的原因是(2)、实验结束后,某同学发现试管中出现的红色物质又变回黑色,其可能的原因是以下的( ).A、实验开始时先给试管加热,然后通氢气; B、盛放氧化铜的试管口略向上倾斜; C、实验结束时先停止通氢气,再停止加热; D、试管外壁可能还有水; E、加热时氢气本身不纯.
(1)、如果要还原得到6.4克铜,则理论上需要消耗0.2克氢气,但实际消耗的氢气质量一定 大于理论值,造成这一结果最主要的原因是(2)、实验结束后,某同学发现试管中出现的红色物质又变回黑色,其可能的原因是以下的( ).A、实验开始时先给试管加热,然后通氢气; B、盛放氧化铜的试管口略向上倾斜; C、实验结束时先停止通氢气,再停止加热; D、试管外壁可能还有水; E、加热时氢气本身不纯.四、解答题(共53分)
-
29. 将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
 (1)、图二从A到B过程中,溶液的pH逐渐(填“增大”或“减小”)。(2)、图二表示酸碱恰好完全反应的点是。(3)、计算稀盐酸中溶质的质量分数。30. 向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:
(1)、图二从A到B过程中,溶液的pH逐渐(填“增大”或“减小”)。(2)、图二表示酸碱恰好完全反应的点是。(3)、计算稀盐酸中溶质的质量分数。30. 向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算: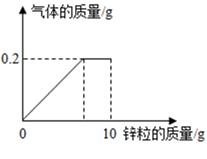 (1)、稀硫酸反应完时,产生氢气的质量为g,消耗锌粒质量为g;(2)、该稀硫酸中溶质的质量分数(写出计算过程)。31. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。小柯用放置很久的铝箔与稀盐酸反应,如图横坐标表示反应时间,根据图像判断,纵坐标可以表示的信息是 , 并作出解答。
(1)、稀硫酸反应完时,产生氢气的质量为g,消耗锌粒质量为g;(2)、该稀硫酸中溶质的质量分数(写出计算过程)。31. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。小柯用放置很久的铝箔与稀盐酸反应,如图横坐标表示反应时间,根据图像判断,纵坐标可以表示的信息是 , 并作出解答。 32. 钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500吨含氧化铁(Fe2O3)64%的赤铁矿石进行炼铁,高炉炼铁的原理为3CO+Fe2O3 2Fe+3CO2。计算(1)、铁矿石中氧化铁的质量为吨;(2)、这些矿石理论上能炼得铁多少吨?(写出简明的计算过程)33. 一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3 .(1)、首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是;(2)、称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下:
32. 钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500吨含氧化铁(Fe2O3)64%的赤铁矿石进行炼铁,高炉炼铁的原理为3CO+Fe2O3 2Fe+3CO2。计算(1)、铁矿石中氧化铁的质量为吨;(2)、这些矿石理论上能炼得铁多少吨?(写出简明的计算过程)33. 一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3 .(1)、首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是;(2)、称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下:样品质量
反应前总质量
反应后总质量
10.6克
148.5克
146.3克
计算生成二氧化碳的质量及该样品中Na2CO3的质量分数.
34. 小芳同学采用如下方法测定石灰石中碳酸钙的质量分数:取该石灰石样品10g,把40g稀盐酸分四次加入,实验过程所得数据如表(石灰石样品中含有的二氧化硅等杂质不溶于水也不与稀盐酸反应)实验次数
加入稀盐酸的质量/g
剩余固体的质量/g
1
10
7.5
2
10
5.0
3
10
3.2
4
10
a
根据实验数据计算:
(1)、表中a的数值为;(2)、求样品中碳酸钙的质量分数(3)、求盐酸中溶质的质量分数。