江苏省启东市2020-2021学年高三上学期化学期中考试试卷
试卷更新日期:2020-12-19 类型:期中考试
一、单选题
-
1. 2020年9月,我国作出对于全球减排具有里程碑意义的承诺:2060年实现碳中和。碳中和是指直接或间接产生的温室气体排放总量,通过植树造林、节能减排、碳捕集与封存等形式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。下列有关说法正确的是( )A、CO2是导致温室效应和酸雨的主要气体 B、煤的液化、气化主要是为了减少CO2的排放 C、CO2催化加氢合成低碳烯烃属于化合反应 D、CO2分子间有间隔,故可将其压缩液化后封存2. 中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下所示。下列说法正确的是( )
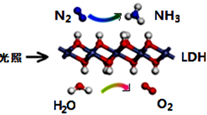 A、该过程中没有非极性键的断裂与生成 B、氧化剂与还原剂的物质的量之比为3︰1 C、基于LDH合成NH3的过程不属于氮的固定 D、利用NH3容易液化的性质,将混合气体加压降温可分离出NH33. 下列离子方程式书写正确的是( )A、K2O2加入H218O中:2K2O2 + 2H218O =4K+ + 4OH- + 18O2↑ B、用铜作电极电解饱和食盐水:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- C、NH4Al(SO4)2溶液与过量KOH溶液反应:Al3++ 4OH-=AlO +2H2O D、用氨水溶解AgOH沉淀:AgOH + 2NH3∙H2O =[Ag(NH3)2]+ + 2H2O + OH-4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,常温下0.01 mol·L-1 Z的最高价氧化物对应的水化物溶液的pH=12,W在元素周期表中的族序数是周期数的2倍。下列说法正确的是( )A、工业上常用电解法冶炼Z单质 B、原子半径:r (Z)>r (W)>r(Y)>r(X) C、X简单气体氢化物的稳定性比Y的强 D、W的最高价氧化物对应的水化物的酸性比Y强5. 下列物质(对应X—Y—Z)不能通过一步反应完成如图转化的是( )
A、该过程中没有非极性键的断裂与生成 B、氧化剂与还原剂的物质的量之比为3︰1 C、基于LDH合成NH3的过程不属于氮的固定 D、利用NH3容易液化的性质,将混合气体加压降温可分离出NH33. 下列离子方程式书写正确的是( )A、K2O2加入H218O中:2K2O2 + 2H218O =4K+ + 4OH- + 18O2↑ B、用铜作电极电解饱和食盐水:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- C、NH4Al(SO4)2溶液与过量KOH溶液反应:Al3++ 4OH-=AlO +2H2O D、用氨水溶解AgOH沉淀:AgOH + 2NH3∙H2O =[Ag(NH3)2]+ + 2H2O + OH-4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,常温下0.01 mol·L-1 Z的最高价氧化物对应的水化物溶液的pH=12,W在元素周期表中的族序数是周期数的2倍。下列说法正确的是( )A、工业上常用电解法冶炼Z单质 B、原子半径:r (Z)>r (W)>r(Y)>r(X) C、X简单气体氢化物的稳定性比Y的强 D、W的最高价氧化物对应的水化物的酸性比Y强5. 下列物质(对应X—Y—Z)不能通过一步反应完成如图转化的是( )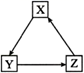 A、Cl2—HClO—HCl B、NO—NO2—HNO3 C、FeO—Fe(OH)2—Fe(OH)3 D、NaOH—Na2CO3—NaHCO36. 下列实验的装置、操作及有关描述均正确的是( )
A、Cl2—HClO—HCl B、NO—NO2—HNO3 C、FeO—Fe(OH)2—Fe(OH)3 D、NaOH—Na2CO3—NaHCO36. 下列实验的装置、操作及有关描述均正确的是( ) A、①:鉴别Al(OH)3和H2SiO3两种胶体 B、②:证明某溶液含有SO C、③:分离乙酸乙酯和饱和碳酸钠溶液 D、④:除去C2H6中含有的C2H47. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、澄清透明的溶液中:Cu2+、NH 、NO 、SO B、加入酚酞为红色的溶液中:Na+、Al3+、SO 、Cl- C、0.2mol∙L-1的KSCN溶液中:Fe2+、K+、CO 、Cl- D、水电离出的c(H+)=1×10-13mol∙L-1的溶液中:K+、Na+、AlO 、CO8. 下列实验结果不能作为相应定律或原理的证据是( )
A、①:鉴别Al(OH)3和H2SiO3两种胶体 B、②:证明某溶液含有SO C、③:分离乙酸乙酯和饱和碳酸钠溶液 D、④:除去C2H6中含有的C2H47. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、澄清透明的溶液中:Cu2+、NH 、NO 、SO B、加入酚酞为红色的溶液中:Na+、Al3+、SO 、Cl- C、0.2mol∙L-1的KSCN溶液中:Fe2+、K+、CO 、Cl- D、水电离出的c(H+)=1×10-13mol∙L-1的溶液中:K+、Na+、AlO 、CO8. 下列实验结果不能作为相应定律或原理的证据是( )A
B
C
D
勒夏特列原理
元素周期律
盖斯定律
阿伏加德罗定律
实
验
方
案


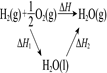

结果
左球气体颜色加深
右球气体颜色变浅
烧瓶中冒气泡,
试管中出现浑浊
测得ΔH为ΔH1、ΔH2的和
H2与O2的体积比约为2︰1
A、A B、B C、C D、D9. 金属插入 的C-H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、金属有机化学等领域,如图是 与Zr形成过渡金属化合物的过程。下列说法错误的是( ) A、在中间产物中 状态最稳定 B、 C、 活化能为 D、整个反应快慢,由 →状态2反应决定10. 下列实验方案中不能达到实验目的的是( )
A、在中间产物中 状态最稳定 B、 C、 活化能为 D、整个反应快慢,由 →状态2反应决定10. 下列实验方案中不能达到实验目的的是( )选项
实验目的
实验方案
A
探究温度对反应速率的影响
2支盛有5 mL相同浓度Na2S2O3溶液的试管分别放在不同温度的水槽中,分别向其中加入5mL相同浓度的稀硫酸溶液,观察现象
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后滴加KSCN溶液观察溶液是否变红
C
配制480mL0.2mol∙L-1CuSO4
将25.0 g CuSO4∙5H2O固体加入蒸馏水中配制成500mL溶液
D
探究碳酸钠溶液中存在水解平衡
向一定浓度的Na2CO3溶液滴入酚酞试液,溶液变红,然后滴加BaCl2溶液,可观察到溶液颜色逐渐变浅直至消失
A、A B、B C、C D、D11. 连接四种不同原子或原子团的碳原子称为手性碳原子,药物阿司匹林(B)可由水杨酸(A)制得。下列说法正确的是( )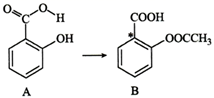 A、阿司匹林能与溴水反应而使之褪色 B、可用氯化铁溶液鉴别水杨酸和阿司匹林 C、由A反应生成B,另一种反应物为乙醇 D、阿司匹林中带星号(*)的碳原子是手性碳原子12. 在一密闭容器中发生反应 。反应过程中,物质A和C的物质的量随某物理量(x)的变化曲线如图所示。下列说法正确的是( )
A、阿司匹林能与溴水反应而使之褪色 B、可用氯化铁溶液鉴别水杨酸和阿司匹林 C、由A反应生成B,另一种反应物为乙醇 D、阿司匹林中带星号(*)的碳原子是手性碳原子12. 在一密闭容器中发生反应 。反应过程中,物质A和C的物质的量随某物理量(x)的变化曲线如图所示。下列说法正确的是( )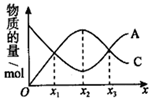 A、若x为温度,则xn对应的平衡常数: B、若x为恒压条件下加入物质B的物质的量,则化学反应速率: C、若x为压强,则 D、对于任何物理量x, 和 处各物质的百分含量和转化率均相同13. H2C2O4为二元弱酸,Ka1= 5.9×10−2 , Ka2= 6.4×10−5 , lg6.4 ≈ 0.8,向20mL0.1mol∙L−1 H2C2O4溶液中滴加0.2mol∙L−1KOH溶液,溶液中含碳微粒的存在形式与物质的量百分比随KOH溶液体积变化如图所示。下列说法正确的是( )
A、若x为温度,则xn对应的平衡常数: B、若x为恒压条件下加入物质B的物质的量,则化学反应速率: C、若x为压强,则 D、对于任何物理量x, 和 处各物质的百分含量和转化率均相同13. H2C2O4为二元弱酸,Ka1= 5.9×10−2 , Ka2= 6.4×10−5 , lg6.4 ≈ 0.8,向20mL0.1mol∙L−1 H2C2O4溶液中滴加0.2mol∙L−1KOH溶液,溶液中含碳微粒的存在形式与物质的量百分比随KOH溶液体积变化如图所示。下列说法正确的是( )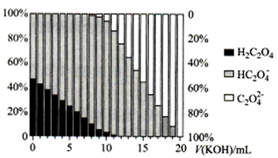 A、滴入10 mL KOH溶液时,溶液呈中性 B、当c( )=c( )时,混合溶液pH≈4.2 C、滴入10 mL KOH溶液时,溶液中有如下关系:c(H2C2O4)+c( )+c( )=0.1mol∙L−1 D、滴入16~20 mL KOH溶液的过程中,均满足c( )>c( )>c(H+)>c(OH−)
A、滴入10 mL KOH溶液时,溶液呈中性 B、当c( )=c( )时,混合溶液pH≈4.2 C、滴入10 mL KOH溶液时,溶液中有如下关系:c(H2C2O4)+c( )+c( )=0.1mol∙L−1 D、滴入16~20 mL KOH溶液的过程中,均满足c( )>c( )>c(H+)>c(OH−)二、多选题
-
14. 碘酸钾(KIO3)是重要的食品添加剂,某化学兴趣小组査阅资料得知,HIO3与KIO3均为白色固体,能溶于水,难溶于部分有机溶剂,且KIO3在碱性条件下易被ClO氧化为KIO4 , 于是设计了以下路线制备碘酸钾。下列有关说法正确的是( )
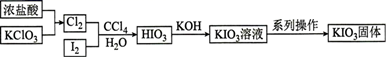 A、浓盐酸在反应中体现了氧化性 B、加入CCl4目的是萃取I2 C、加入KOH前,应先对原溶液加热煮沸 D、系列操作包括:加入乙醇溶液、搅拌、静置、过滤、洗涤、干燥15. 一种可充电锂离子电池的示意图如下,已知 中 ,下列关于锂离子电池的说法正确的是( )
A、浓盐酸在反应中体现了氧化性 B、加入CCl4目的是萃取I2 C、加入KOH前,应先对原溶液加热煮沸 D、系列操作包括:加入乙醇溶液、搅拌、静置、过滤、洗涤、干燥15. 一种可充电锂离子电池的示意图如下,已知 中 ,下列关于锂离子电池的说法正确的是( )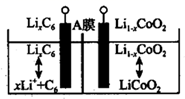 A、放电时电池总反应为 B、放电时, 在电解质中由负极通过A膜向负极迁移 C、充电时,若转移1mol ,左侧电极将增重 D、充电时,阳极的电极反应式为
A、放电时电池总反应为 B、放电时, 在电解质中由负极通过A膜向负极迁移 C、充电时,若转移1mol ,左侧电极将增重 D、充电时,阳极的电极反应式为三、工业流程题
-
16. 工业上用绿矾制取还原性铁粉的简单工艺流程如下:
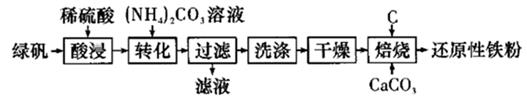 (1)、绿矾用酸浸而不用水浸的原因是;转化过程中为了加快转化速率,需适当加热,但是温度不宜过高的原因是。(2)、干燥过程是为了脱去沉淀FeCO3∙nH2O表面的水和结晶水,该过程会产生一种杂质FeO(OH),写出化学方程式:;为了避免干燥过程中生成FeO(OH),正确操作是。(3)、下图是焙烧过程中加CaCO3与未加CaCO3的铁粉产率变化图,请分析加入CaCO3导致铁粉产率提高的原因:。
(1)、绿矾用酸浸而不用水浸的原因是;转化过程中为了加快转化速率,需适当加热,但是温度不宜过高的原因是。(2)、干燥过程是为了脱去沉淀FeCO3∙nH2O表面的水和结晶水,该过程会产生一种杂质FeO(OH),写出化学方程式:;为了避免干燥过程中生成FeO(OH),正确操作是。(3)、下图是焙烧过程中加CaCO3与未加CaCO3的铁粉产率变化图,请分析加入CaCO3导致铁粉产率提高的原因:。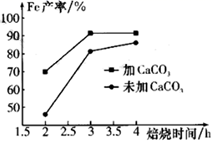 (4)、还原性铁粉中含有少量的FexC,用下列装置通过检测CO2来测定还原性铁粉中碳的含量,则各装置的连接顺序为。
(4)、还原性铁粉中含有少量的FexC,用下列装置通过检测CO2来测定还原性铁粉中碳的含量,则各装置的连接顺序为。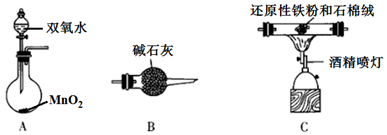 17. 二氧化氯(ClO2 , 黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:(1)、实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
17. 二氧化氯(ClO2 , 黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:(1)、实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2: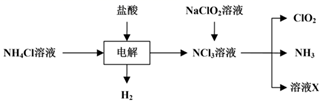
①电解时发生反应的化学方程式为。
②溶液X中大量存在的阴离子有。
(2)、用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是(填标号)。a 明矾 b 碘化钾 c 盐酸 d 硫酸亚铁
(3)、用如图装置可以测定混合气中 ClO2的含量: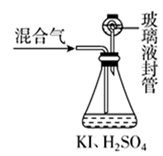
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;(ClO2+I-+H+ → I2+H2O+Cl-)
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用 0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O =2I-+S4O )指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①玻璃液封装置的作用是。
②测得混合气中ClO2的质量为g(写出计算过程)。
四、结构与性质
-
18. 钯(46Pd)催化剂在有机合成中有着重要的地位。请回答以下问题:(1)、钯与镍是同族元素,它们位于周期表的(选填s、p、d、ds、f)区。(2)、四(三苯基膦)钯(
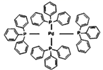 )是一种常见的钯催化剂,也是一种配合物,其配位数为 , 其中“三苯基膦”中磷原子与键合的三个碳原子构成的立体结构为 。 (3)、
)是一种常见的钯催化剂,也是一种配合物,其配位数为 , 其中“三苯基膦”中磷原子与键合的三个碳原子构成的立体结构为 。 (3)、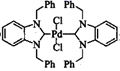 是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为。配体中碳原子的杂化类型有 , 其中氯原子的价电子轨道表达式为。
是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为。配体中碳原子的杂化类型有 , 其中氯原子的价电子轨道表达式为。 五、原理综合题
-
19. 氮的重要化合物如氨(NH3)、肼(N2H4)等,在生产、生活中具有重要作用。(1)、已知200℃时,反应Ⅰ:
反应Ⅱ:
写出200℃时,肼分解为氮气和氢气的热化学方程式:。
(2)、氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。在Co—Al催化剂体系中,压强 下氨气以一定流速通过反应器,得到不同催化剂下氨气转化率随温度变化曲线如图,活化能最小的催化剂为。同一催化剂下,温度高时NH3的转化率接近平衡转化率的原因是。如果增大气体流速,则 点对应的点可能为(填“a、c、d、e、f”)。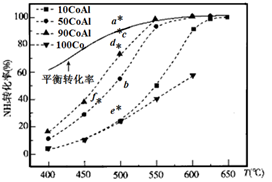 (3)、氨硼烷(NH3∙BH3)是氮和硼的氢化物,易溶于水,易燃。氨硼烷(NH3∙BH3)电池可在常温下工作,装置如图所示,电池反应为NH3∙BH3+3H2O2 =NH4BO2+4H2O。已知H2O2足量,未加入氨硼烷之前,两极室质量相等。
(3)、氨硼烷(NH3∙BH3)是氮和硼的氢化物,易溶于水,易燃。氨硼烷(NH3∙BH3)电池可在常温下工作,装置如图所示,电池反应为NH3∙BH3+3H2O2 =NH4BO2+4H2O。已知H2O2足量,未加入氨硼烷之前,两极室质量相等。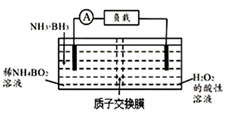
①负极电极反应式为。
②工作足够长时间后,若左右两极质量差为3.8g,则电路中转移电子的物质的量为。
六、有机推断题
-
20. 碘海醇是临床中应用广泛的一种造影剂,化合物G是合成碘海醇的中间体,其合成路线如下:
 (1)、C中含氧官能团的名称为。(2)、C→D的反应类型为。(3)、E→F的反应中,可生成一种有机副产物X,写出X的结构简式:。(4)、H是D的同系物,分子式为C10H11NO4 , 写出一种同时满足下列条件的H的同分异构体的结构简式:。
(1)、C中含氧官能团的名称为。(2)、C→D的反应类型为。(3)、E→F的反应中,可生成一种有机副产物X,写出X的结构简式:。(4)、H是D的同系物,分子式为C10H11NO4 , 写出一种同时满足下列条件的H的同分异构体的结构简式:。①属于α-氨基酸;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有6种不同化学环境的氢。
(5)、写出以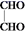 和
和 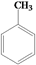 为原料制备
为原料制备  的合成路线流程图(无机试剂任选,合成路线流程图的示例见本题题干)。
的合成路线流程图(无机试剂任选,合成路线流程图的示例见本题题干)。
-
-