安徽省皖南名校2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2020-12-19 类型:期中考试
一、单选题
-
1. 下列民俗、诗句、谚语等包含吸热反应的是( )A、民间焰火之最——确山打铁花 B、千锤万凿出深山,烈火焚烧若等闲 C、只要功夫深,铁杵磨成针 D、冰,水为之,而寒于水2. 对化学反应速率和平衡的研究具有十分重要的意义,下列认识正确的是( )A、用冰箱冷藏食物,能使其永远不腐败变质 B、尾气转化催化剂可以完全消除汽车尾气污染 C、调整反应条件无法使可逆反应正向进行到底 D、化学反应速率越快可逆反应正向进行的程度越大3. 能源与可持续发展密切相关,下列说法正确的是( )A、直接开采的化石燃料完全燃烧不会造成大气污染 B、从海洋中开采的“可燃冰”释放出的气体与天然气成分相同 C、二氧化碳、水通过人工光合作用生成有机物同时放出能量 D、“干热岩”(温度大于 的高温岩体)是最具应用价值和利用潜力的清洁能源,该能源属于化石能源4. 被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )A、化学反应前后质量守恒 B、低温下分子无法运动 C、温度降低,化学反应停止 D、温度越低,化学反应越慢5. 下列有关化学反应速率和化学平衡的说法错误的是( )A、对于化学反应来说,反应速率越快,反应现象不一定越明显 B、N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时,升高温度,反应速率υ(H2)和氢气的平衡转化率均增大 C、化学反应速率理论可指导怎样在一定时间内快出产品,化学平衡理论可指导怎样用有限的原料多出产品 D、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH>06. 对于XOH型化合物而言(X是除H,O外的其它元素),下列说法中正确的是( )A、XOH的水溶液不能导电 B、XOH不可能是酸 C、当X是碱金属时,它一定是强碱 D、XOH一定是共价化合物7. 下列化学方程式中,正确的是( )A、甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol B、一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-2akJ/mol C、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol D、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2发生中和反应生成2molH2O的反应热△H=-114.6kJ/mol8. 2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
①CO:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
②丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2221.5kJ/mol
③正丁烷:C4H10(l)+6.5O2(g)=4CO2(g)+5H2O(l) △H=-2855.4kJ/mol
④异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l) △H=-2869.6kJ/mol
下列说法正确的是( )
A、常温常压下,正丁烷的燃烧热为-2855.4kJ/mol B、相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 C、常温下,CO的燃烧热为566.0kJ/mol D、人类利用的能源都是通过化学反应获得的9. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( ) A、1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ B、通常情况下,N2(g)和O2(g)混合能直接生成NO C、1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 D、NO是一种红棕色的气体,能与水反应生成硝酸10. 下列事实能说明醋酸是弱电解质的是( )
A、1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ B、通常情况下,N2(g)和O2(g)混合能直接生成NO C、1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 D、NO是一种红棕色的气体,能与水反应生成硝酸10. 下列事实能说明醋酸是弱电解质的是( )①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸溶液中存在醋酸分子;
④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥pH=3的醋酸溶液加水稀释至原溶液体积的10倍后,pH<4;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢。
A、②⑥⑦ B、①② C、③④⑤⑥ D、③④⑥⑦11. CO2加氢制CH4的一种催化机理如图,下列说法正确的是( ) A、催化过程使用的催化剂为La2O3和La2O2CO3 B、La2O2CO3可以释放出CO2*(活化分子) C、H2经过Ni活性中心裂解产生活化态H*的过程为放热过程 D、CO2加氢制CH4的过程只需要La2O3催化即可完成12. 某同学做浓度对化学反应速率的影响的实验时,将3支试管分别编号为①②③,实验结束后记录的数据如表所示。
A、催化过程使用的催化剂为La2O3和La2O2CO3 B、La2O2CO3可以释放出CO2*(活化分子) C、H2经过Ni活性中心裂解产生活化态H*的过程为放热过程 D、CO2加氢制CH4的过程只需要La2O3催化即可完成12. 某同学做浓度对化学反应速率的影响的实验时,将3支试管分别编号为①②③,实验结束后记录的数据如表所示。试管编号
加3% 溶液
加
加 溶液
出现浑浊的时间
①
5滴
②
5滴
③
5滴
下列叙述错误的是( )
A、反应的化学方程式为 B、 的浓度越大,反应速率越快 C、 D、13. 钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法错误的是( ) A、盐酸的浓度越大,腐蚀速率越快 B、钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小 C、碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比 D、对比盐酸和硫酸两条曲线,可知Cl-也会影响碳素钢的腐蚀速率14. 对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:
A、盐酸的浓度越大,腐蚀速率越快 B、钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小 C、碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比 D、对比盐酸和硫酸两条曲线,可知Cl-也会影响碳素钢的腐蚀速率14. 对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:第一步:2NO(g) N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g) 2NO2(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v正=k1正·c2(NO),v逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。
下列叙述正确的是( )
A、整个反应的速率由第一步反应速率决定 B、同一温度下,平衡时第一步反应的 越大,反应正向程度越大 C、第二步反应速率慢,因而平衡转化率也低 D、第一步反应快的原因是第一步反应的活化能比第二步反应的活化能高15. 某温度下,重水中存在电离平衡D2O D++OD- , D2O的离子积常数为1.0×10﹣12 , 若pD=-lg c(D+),该温度下有关分析错误的是( )A、0.1 mol NaOD溶于重水制成1 L溶液,pD=13 B、将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6 C、向30 mL0.5 mol/L NaOD的重水溶液中加入20 mL 0.5 mol/L DCl的重水溶液,所得溶液pD = 11 D、pD = 10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10﹣10mol/L16. 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定体积均是20mL、浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )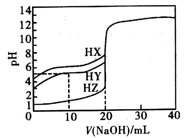 A、酸性强弱顺序是HX>HY>HZ B、由图象可知,HY为弱酸,其电离常数数量级为10-6 C、pH=2的HZ溶液加水稀释10倍,pH为3 D、加入20mLNaOH溶液时,只有HY溶液达到滴定终点
A、酸性强弱顺序是HX>HY>HZ B、由图象可知,HY为弱酸,其电离常数数量级为10-6 C、pH=2的HZ溶液加水稀释10倍,pH为3 D、加入20mLNaOH溶液时,只有HY溶液达到滴定终点二、实验题
-
17. KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02mol·L-1、0.002mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol·L-1、4mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL。
(1)、已知:①H2C2O4电离常数,Ka1=5.9×10-2 , Ka2=6.4×10-5。②与KMnO4反应时,H2C2O4转化为CO2和H2O。
写出草酸与酸性高锰酸钾溶液反应的离子方程式。
(2)、若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成组实验进行对比即可得出结论。(3)、在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:KMnO4酸性溶液浓度(mol•L-1)
溶液褪色所需时间(min)
第一次
第二次
第三次
0.02
14
13
11
0.002
6.7
6.6
6.7
①用0.002mol·L-1KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
KMnO4酸性溶液
H2C2O4溶液
浓度/mol•L-1
体积(mL)
浓度/mol•L-1
体积(mL)
0.02
2
b
4
a
2
c
4
则表中a=;b=;c=。
(4)、测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应初始时变化不大一段时间后快速增大的原因:。
三、计算题
-
18.(1)、25℃时,CH3COOH和NH3×H2O的电离常数相等。取10mL0.1mol×L-1醋酸溶液测得其pH=3。0.1mol×L-1氨水(NH3×H2O溶液)的pH=。用pH试纸测定该氨水pH的操作方法为。(2)、某温度(t℃)时,测得0.01 mol×L-1的NaOH溶液的pH=11,则该温度下水的KW=。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,若所得混合液为中性,且a+b=12,则Va: Vb。(3)、25℃时,0.1 mol×L-1的HA溶液中 。请回答下列问题:
①HA是(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是(填字母)。
a.c(HA) b. c.c(H+)与c(OH-)的乘积 d.c(OH-)
四、原理综合题
-
19. CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)、在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量(填“>”、“<”或“="”)890.3" kJ。(2)、甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2= 2CO+2H2 , 1 g CH4完全反应可释放15.46 kJ的热量,则:
①上图(所有物质均为气态)能表示该反应过程中能量变化的是(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为。
 (3)、C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=。(4)、目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。A、寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量 B、将固态碳合成为C60 , 以C60作为燃料 C、寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)20. 研究氮及其化合物的性质及转化,对研究自然界中氮的循环有着重大的意义。(1)、科学家研究利用铁触媒合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
(3)、C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=。(4)、目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。A、寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量 B、将固态碳合成为C60 , 以C60作为燃料 C、寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)20. 研究氮及其化合物的性质及转化,对研究自然界中氮的循环有着重大的意义。(1)、科学家研究利用铁触媒合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
由图可知合成氨反应N2(g)+3H2(g) 2NH3(g)的△H=kJ·mol-1。该历程中速率最慢的一步的化学方程式为。
(2)、NH3(g)的催化氧化是工业制备硝酸的重要反应。已知氨催化氧化时会发生如下两个竞争反应I、II。4NH3(g)+5O2(g) 4NO(g)+6H2O(g) I
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H<0 II
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2 , 测得有关物质的物质的量与温度的关系如图所示。

①该催化剂在低温时选择反应 (填“I”或“II”)。
②520℃时,4NH3(g)+3O2(g) 2N2(g)+6H2O(g)的平衡常数K=(不要求得出计算结果,只需列出数字计算式)。
③C点比B点所产生的NO的物质的量少的主要原因是。
五、工业流程题
-
21. 重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。

已知:①NaFeO2遇水剧烈反应;
②2CrO (黄色)+2H+ Cr2O (橙色)+H2O
请回答下列问题:
(1)、NaFeO2中Fe的化合价是;高温灼烧铬铁矿时至少反生个氧化还原反应(填数字)。(2)、滤渣1中有红褐色物质,写出生成该物质反应的离子方程式。滤渣2的主要成分是和H2SiO3(填化学式)。(3)、向Na2Cr2O7溶液中加入KCl固体,得到K2Cr2O7晶体的操作是。(4)、25℃时,对反应2CrO (黄色)+2H+ Cr2O (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:时间/(s)
0
0.01
0.02
0.03
0.04
CrO /(mol·L-1)
0.20
1.6×10-2
1.2×10-2
1.0×10-2
Cr2O /(mol·L-1)
0
9.2×10-2
9.4×10-2
9.5×10-2
①反应达到平衡时,溶液的pH=l,该反应平衡常数K为。
②下列有关说法正确的是。
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时υ(CrO )(正)=2υ(Cr2O )(逆)
c.溶液中c(CrO ):c(Cr2O )=2:1时该反应已达平衡状态
d.反应达到平衡时CrO 的转化率为95%
-
-