初中化学人教版九年级下册第九单元课题2溶解度
试卷更新日期:2020-12-15 类型:同步测试
一、单选题
-
1. 下列有关溶液的叙述正确的是( )A、饱和溶液一定比不饱和溶液浓度大 B、饱和溶液就是不能再溶解任何物质的溶液 C、一份溶液中可以含有多种溶质 D、均一、稳定的液体一定是溶液2. a、b两种固体物质的溶解度曲线如图所示,下列说法中不正确的是( )
 A、t1℃时,a、b物质的溶解度相等 B、a物质的溶解度随温度的升高而增大,b物质的溶解度随温度的升高而减小 C、t2℃时,将a、b两物质的饱和溶液分别降温至t1℃,所得的溶液溶质质量分数相等 D、提纯a中混有少量的b,可采用降温结晶的方法3.
A、t1℃时,a、b物质的溶解度相等 B、a物质的溶解度随温度的升高而增大,b物质的溶解度随温度的升高而减小 C、t2℃时,将a、b两物质的饱和溶液分别降温至t1℃,所得的溶液溶质质量分数相等 D、提纯a中混有少量的b,可采用降温结晶的方法3.如图是A、B、C三种固体物质的溶解度曲线.下列分析不正确的是( )
 A、50℃时,三种物质的溶解度由大到小的顺序是A>B>C B、50℃时,把50gA放入50g水中能形成75gA的饱和溶液 C、将C的饱和溶液变为不饱和溶液,可采用降温的方法 D、分别将三种物质的饱和溶液从50℃将至20℃时,所得溶液溶质质量分数大小关系是B>C=A4. K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是( )
A、50℃时,三种物质的溶解度由大到小的顺序是A>B>C B、50℃时,把50gA放入50g水中能形成75gA的饱和溶液 C、将C的饱和溶液变为不饱和溶液,可采用降温的方法 D、分别将三种物质的饱和溶液从50℃将至20℃时,所得溶液溶质质量分数大小关系是B>C=A4. K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是( )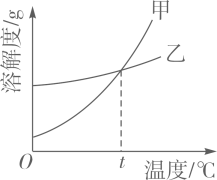
温度/℃
20
40
50
60
80
溶解度/g
K2CO3
110
117
121
126
139
KNO3
31.6
63.9
85.5
110
169
A、K2CO3的溶解度大于KNO3 B、乙代表K2CO3的溶解度曲线 C、t应在50℃~60℃之间 D、40℃时,100gKNO3饱和溶液中含63.9gKNO35. 某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是( ) A、M的溶解度曲线为a曲线 B、升温可以使N的饱和溶液变浑浊 C、M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大 D、如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N6. 10℃时,将3g甲、乙两种可溶性固体分别放入盛有10mL水的试管中。两种物质的溶解情况(见图I),两种物质的溶解度随温度的变化(见图Ⅱ)。下面对甲、乙两物质的判断,错误的是( )
A、M的溶解度曲线为a曲线 B、升温可以使N的饱和溶液变浑浊 C、M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大 D、如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N6. 10℃时,将3g甲、乙两种可溶性固体分别放入盛有10mL水的试管中。两种物质的溶解情况(见图I),两种物质的溶解度随温度的变化(见图Ⅱ)。下面对甲、乙两物质的判断,错误的是( )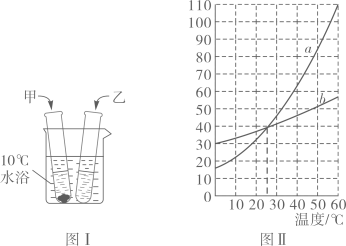 A、10℃时,甲、乙两物质的溶液都是饱和溶液 B、温度升高至25℃时,甲、乙两物质的溶液都是不饱和溶液 C、甲物质对应的溶解度曲线为a D、可用降温结晶法分离甲、乙两种物质的混合物7. 本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
A、10℃时,甲、乙两物质的溶液都是饱和溶液 B、温度升高至25℃时,甲、乙两物质的溶液都是不饱和溶液 C、甲物质对应的溶解度曲线为a D、可用降温结晶法分离甲、乙两种物质的混合物7. 本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
关于图乙中烧杯内的物质,下列说法正确的是( )
A、R物质是氯化铵 B、溶液的溶质质量分数是烧杯①小于烧杯② C、若使烧杯③中的固体溶解,只能采用加水的方法 D、烧杯①②③中,只有烧杯③中上层清液是饱和溶液8. 甲、乙试管中各盛有10.0g水,向其中一支中加入3.0gKNO3固体,另一支中加入3.0gNaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是( )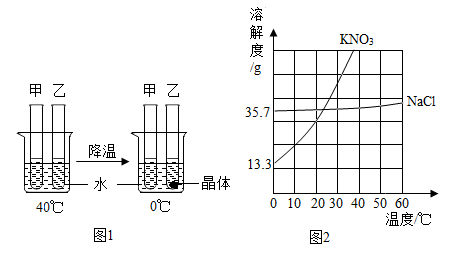 A、甲中加入的固体是KNO3 B、0℃时,甲中溶液可能饱和,乙中溶液一定饱和 C、KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯 D、40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
A、甲中加入的固体是KNO3 B、0℃时,甲中溶液可能饱和,乙中溶液一定饱和 C、KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯 D、40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量二、填空题
-
9. 作图法是常用的数据处理方法。如图是A、B、C三种物质的溶解度曲线图,请回答下列问题:
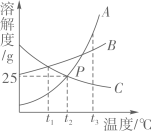 (1)、P点的意义是。(2)、t3℃时,A,B,C三种物质溶解度最大的是。(3)、将某温度下C的不饱和溶液变成饱和溶液的方法是。(写一种)(4)、在t3℃时,将A,B,C的饱和溶液分别降温到t1℃时所得溶液溶质的质量分数由大到小的顺序是。10. 将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
(1)、P点的意义是。(2)、t3℃时,A,B,C三种物质溶解度最大的是。(3)、将某温度下C的不饱和溶液变成饱和溶液的方法是。(写一种)(4)、在t3℃时,将A,B,C的饱和溶液分别降温到t1℃时所得溶液溶质的质量分数由大到小的顺序是。10. 将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。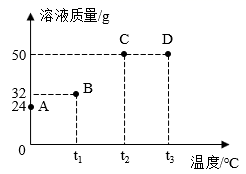
回答下列问题:
(1)、A、B两点对应的溶液中溶质的质量分数较大的是(填字母编号)。(2)、0℃时,物质X的溶解度是。(3)、A、B、C、D四点对应的溶液中,一定属于饱和溶液的是(填字母编号)。(4)、下列说法正确的是(填序号)。①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
11. 根据如表回答问题.温度(℃)
20
40
50
60
80
溶解度(g/100g水)
NaCl
36.0
36.6
37.0
37.3
38.4
NH4Cl
37.2
45.8
50.4
55.2
65.6
KNO3
31.6
63.9
85.5
110
169
①20℃时,溶解度最大的物质是
②50℃时,100g水中最多溶解NaClg
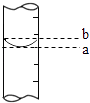
③量筒的局部示意见图,量取水时应沿视线(选填“a”或“b”)进行读数,视线(选填“a”或“b”)对应的读数较大.
④A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体.

Ⅰ.A溶液为(选填“饱和”或“不饱和”)溶液
Ⅱ.对以上过程的分析,正确的是(选填编号)
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.开始析出KNO3固体的温度在60℃至80℃之间
d.A溶液的质量等于222g.
三、综合题
-
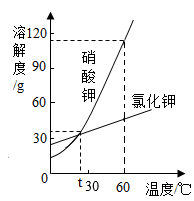
12. 硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
温度/℃
10
20
30
40
50
60
溶解度/g
甲
20.9
31.6
45.8
63.9
85.5
110
乙
31.0
34.0
37.0
40.0
42.6
45.5
请回答下列问题:
(1)、观察溶解度曲线和溶解度表,判断物质乙是指(填写化学式)。(2)、60℃时,饱和KNO3溶液中混有少量KCl,应采用的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。(3)、60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3 KCl(填写“>”“=”或“<”)。(4)、如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是(填写字母标号)。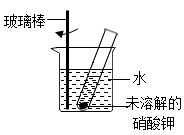
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)、60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是。13. 下表是甲和乙在不同温度时水中的溶解度,根据此表回答:温度/℃
10
20
30
40
50
溶解度/g
甲
30
33
35
38
41
乙
21
31
45
65
88
(1)、从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是。(2)、在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为g。(3)、由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度xg。则x取值范围是。(4)、某同学取甲、乙中的一种物质,按如图所示进行实验,下列有关说法错误的是(填序号)。
①烧杯中加入的是乙
②w取值为50
③40℃时,甲、乙的饱和溶液中溶质的质量乙>甲
④将等质量的甲、乙分别加入等质量的水中,所得溶液的溶质质量分数甲=乙
14. 如图1是A,B,C三种物质的溶解度曲线,请回答。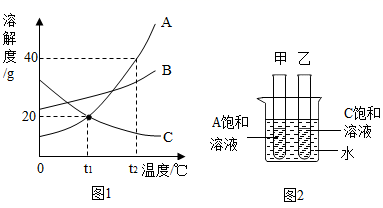 (1)、t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为。(2)、A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是。(3)、t1℃时,取等质量的A、C饱和溶液分别置于甲,乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是15. KNO3和KCl在不同温度时的溶解度如下表所示:
(1)、t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为。(2)、A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是。(3)、t1℃时,取等质量的A、C饱和溶液分别置于甲,乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是15. KNO3和KCl在不同温度时的溶解度如下表所示:温度/℃
0
10
20
30
40
50
60
70
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
138
KCl
27.6
31.0
34.0
37.0
40.0
42.6
45.5
48.3
回答下列问题:
(1)、20℃时,KCl的溶解度为g。(2)、依据表中数据,绘制KNO3和KCl的溶解度曲线,下图中能表示KCl溶解度曲线的是(选填“a”或“b”)。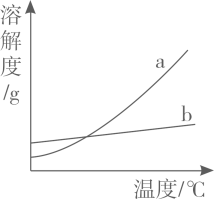 (3)、20℃时,向10g水中加入2.5gKNO3充分搅拌得到X,再加入2.5gKNO3充分搅拌得到Y,继续升温至50℃得到Z,则X、Y、Z中为饱和溶液的是。(4)、40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃。下列说法正确的是______________。A、40℃时,硝酸钾饱和溶液中水的质量大于氯化钾饱和溶液中水的质量 B、降温至10℃时,析出的KNO3晶体质量比析出的KCl晶体质量大 C、降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数 D、当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等
(3)、20℃时,向10g水中加入2.5gKNO3充分搅拌得到X,再加入2.5gKNO3充分搅拌得到Y,继续升温至50℃得到Z,则X、Y、Z中为饱和溶液的是。(4)、40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃。下列说法正确的是______________。A、40℃时,硝酸钾饱和溶液中水的质量大于氯化钾饱和溶液中水的质量 B、降温至10℃时,析出的KNO3晶体质量比析出的KCl晶体质量大 C、降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数 D、当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等