初中化学人教版九年级下册第九单元单元检测卷
试卷更新日期:2020-12-14 类型:单元试卷
一、单选题
-
1. 下列厨房用品中,加到水中充分搅拌能形成溶液的是( )A、花椒粉 B、面粉 C、白糖 D、花生油2. 下列有关溶液叙述正确的是( )A、升高温度时,物质的溶解度一定增大 B、凡是均一、稳定的液体都是溶液 C、养鱼池常把水喷向空中,可以增加养鱼池中氧气的溶解度 D、碘酒溶液中的溶质是I23. 将下列固体分别放入水中,可使溶液温度明显降低的是( )A、硝酸铵 B、熟石灰 C、烧碱 D、食盐4. 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
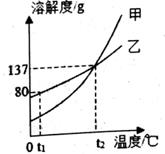 A、甲的溶解度大于乙的溶解度 B、t2℃时甲、乙的饱和溶液中溶质的质量分数相等 C、t1℃时乙的饱和溶液降温析出固体后变为不饱和溶液 D、将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大5. 用溶质质量分数为36%的浓盐酸配制一定浓度的稀盐酸时,不会用到的仪器是( )A、
A、甲的溶解度大于乙的溶解度 B、t2℃时甲、乙的饱和溶液中溶质的质量分数相等 C、t1℃时乙的饱和溶液降温析出固体后变为不饱和溶液 D、将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大5. 用溶质质量分数为36%的浓盐酸配制一定浓度的稀盐酸时,不会用到的仪器是( )A、 B、
B、 C、
C、 D、
D、 6. 甲、乙、丙三种固体物质溶解度曲线如下图所示。下列说法错误的是( )
6. 甲、乙、丙三种固体物质溶解度曲线如下图所示。下列说法错误的是( ) A、t1℃时,甲、乙的溶解度都是25g B、t1℃时,将三种物质的饱和溶液均升温到t2℃,能析出晶体的是丙 C、将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6% D、t3℃时,将20g乙加入到50g水中充分搅拌后剩余5g乙未溶解7. 农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是( )
A、t1℃时,甲、乙的溶解度都是25g B、t1℃时,将三种物质的饱和溶液均升温到t2℃,能析出晶体的是丙 C、将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6% D、t3℃时,将20g乙加入到50g水中充分搅拌后剩余5g乙未溶解7. 农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是( ) A、实验操作顺序为④②①⑤③ B、②中需称量NaCl的质量为16.0g C、选用100mL量筒量取所需水的体积 D、用量筒量取水时仰视读数所得溶液的溶质质量分数偏大8. 20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A、实验操作顺序为④②①⑤③ B、②中需称量NaCl的质量为16.0g C、选用100mL量筒量取所需水的体积 D、用量筒量取水时仰视读数所得溶液的溶质质量分数偏大8. 20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )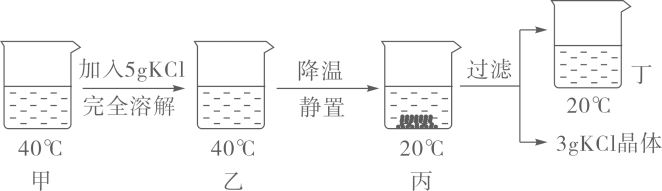 A、甲烧杯中是KCl的饱和溶液 B、乙和丙烧杯中KCl的质量分数相等 C、丁烧杯中KCl的质量分数为34% D、若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g9. 某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如下图所示,下列分析正确的是( )
A、甲烧杯中是KCl的饱和溶液 B、乙和丙烧杯中KCl的质量分数相等 C、丁烧杯中KCl的质量分数为34% D、若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g9. 某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如下图所示,下列分析正确的是( )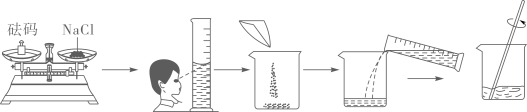 A、配制过程中出现了两处操作错误 B、实验操作步骤为:计算、称量、量取、蒸发 C、若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小 D、配制时应称量氯化钠固体质量为70g10. 如图四个图像不能正确反映对应变化关系的是( )A、
A、配制过程中出现了两处操作错误 B、实验操作步骤为:计算、称量、量取、蒸发 C、若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小 D、配制时应称量氯化钠固体质量为70g10. 如图四个图像不能正确反映对应变化关系的是( )A、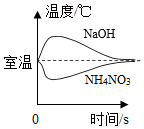 把NaOH和NH4NO3固体分别溶于水中
B、
把NaOH和NH4NO3固体分别溶于水中
B、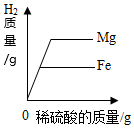 分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C、
分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C、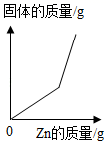 向一定质量硝酸银的混合溶液中逐渐加入锌粉
D、
向一定质量硝酸银的混合溶液中逐渐加入锌粉
D、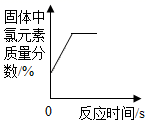 加热一定质量氯酸钾和二氧化锰的固体混合物
11. 关于如图所示实验的相关判断错误的是( )
加热一定质量氯酸钾和二氧化锰的固体混合物
11. 关于如图所示实验的相关判断错误的是( )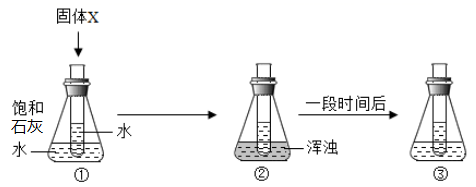 A、固体X可能是NaOH B、固体X可能是NH4NO3 C、Ca(OH)2溶解度:①>② D、Ca(OH)2质量分数:①=③12. 下列关于“相等”的说法错误的是( )A、化学反应前后分子个数一定相等 B、原子中核外电子数与核内质子数一定相等 C、浓溶液在加水稀释前后溶质的质量一定相等 D、化合物中元素化合价的正价总和与负价总和绝对值一定相等13. 硝酸钾的溶解度曲线如图所示。下列说法正确的是( )
A、固体X可能是NaOH B、固体X可能是NH4NO3 C、Ca(OH)2溶解度:①>② D、Ca(OH)2质量分数:①=③12. 下列关于“相等”的说法错误的是( )A、化学反应前后分子个数一定相等 B、原子中核外电子数与核内质子数一定相等 C、浓溶液在加水稀释前后溶质的质量一定相等 D、化合物中元素化合价的正价总和与负价总和绝对值一定相等13. 硝酸钾的溶解度曲线如图所示。下列说法正确的是( )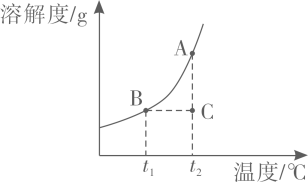 A、氢氧化钙的溶解度曲线与硝酸钾相似 B、A,B,C三点对应的溶液均为饱和溶液 C、溶质的质量分数:A>B>C D、从硝酸钾溶液中获得晶体的方法:蒸发浓缩、冷却结晶14. 如图是甲、乙、丙三种固体物质在水中的溶解度曲线。
A、氢氧化钙的溶解度曲线与硝酸钾相似 B、A,B,C三点对应的溶液均为饱和溶液 C、溶质的质量分数:A>B>C D、从硝酸钾溶液中获得晶体的方法:蒸发浓缩、冷却结晶14. 如图是甲、乙、丙三种固体物质在水中的溶解度曲线。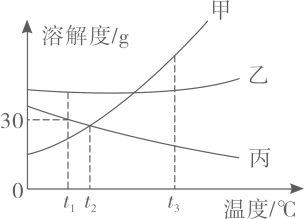
下列说法正确的是( )
A、t1℃时丙的饱和溶液升温到t3℃变为不饱和溶液 B、t2℃时,甲、丙两种物质的溶解度相等 C、甲中混有少量的乙,可采用蒸发结晶的方法提纯甲 D、t1℃时将20克丙物质溶于50克水中得到70克溶液15. 氢氧化钠和碳酸钠的溶解度如表1所示。溶剂
氢氧化钠
碳酸钠
20℃
40℃
20℃
40℃
水
109g
129g
21.8g
49g
酒精
17.3g
40g
难溶
难溶
下列有关分析和推理错误的是( )
A、氢氧化钠易溶于水和酒精 B、温度相同,同种物质在不同溶剂中溶解度不同 C、40℃碳酸钠饱和水溶液溶质质量分数为49% D、20℃时,将足量二氧化碳通入饱和氢氧化钠酒精溶液中,溶液变浑浊二、填空题
-
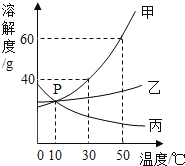
16.
甲、乙、丙三种固体物质在水中的溶解度曲线如图所示.请回答:
(1)图中P点的意义是 ;
(2)若甲中混有少量的乙,最好采用 的方法提纯甲;
(3)使30℃接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是 ;
(4)使50℃甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的是 ;
(5)向100g 50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出.你认为“全部溶解”的原因可能是 .
 17. 分析处理图表中的信息是学习化学的一种重要方法.(1)、如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
17. 分析处理图表中的信息是学习化学的一种重要方法.(1)、如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
①40℃时,氯化钠的溶解度为g.
②碳酸钠的溶解度随温度的升高而(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为 (计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是 .
三、综合题
-
18. 生活中处处有化学,根据下列信息回答问题:

 (1)、洗涤剂除油污是利用洗涤剂的作用(2)、喝了汽水会打嗝,说明气体物质的溶解度(3)、铝制品抗腐蚀的原因(用化学方程式表示)(4)、医用酒精中乙醇的为(5)、海水晒盐的大致过程如下图,其中A处池。此时池中溶液是氯化钠的(“饱和”或“不饱和”)溶液
(1)、洗涤剂除油污是利用洗涤剂的作用(2)、喝了汽水会打嗝,说明气体物质的溶解度(3)、铝制品抗腐蚀的原因(用化学方程式表示)(4)、医用酒精中乙醇的为(5)、海水晒盐的大致过程如下图,其中A处池。此时池中溶液是氯化钠的(“饱和”或“不饱和”)溶液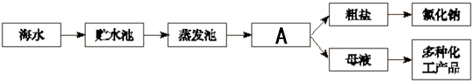 19. 小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如图所示.
19. 小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如图所示.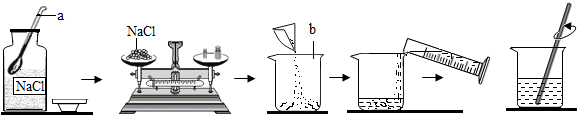
试回答下列问题:
(1)、写出图中有标号仪器的名称:a , b.(2)、图示实验中有一处明显的不符合题意是;图示实验中玻璃棒的作用是 .(3)、小刚同学要配制80g质量分数为6%的氯化钠溶液,需要量取水的体积为mL(水的密度近似看作1g/cm3).(4)、小明在称量氯化钠时把氯化钠和砝码弄反了,则实际称量的氯化钠的质量为(1克以下用游码):;(5)、另一学生用该6%的氯化钠溶液(密度为:1.04克/cm3)去配制80克质量分数为3%的氯化钠溶液,则需要6%的NaCl溶液:克;水:mL。(6)、经检测,所配制溶液的溶质质量分数偏小,其原因可能是(填序号)。①氯化钠固体不纯
②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
20. 溶解度可表示物质溶解性的大小.(1)、如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.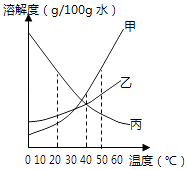
①20℃时,甲的溶解度(填“>”、“<”或“=”)乙的溶解度.
②40℃时,乙和丙(填“能”或“不能”)形成溶质质量分数相同的饱和溶液.
③20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填写下表.
烧杯中的溶质
烧杯中固体的变化
甲
固体逐渐
乙
固体逐渐
丙
固体逐渐
(2)、气体的溶解度也有一定的变化规律:打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越 . 为增大CO2的溶解度,可采用的一种方法是 .
四、计算题
-
21. 84消毒液的有效成分是次氯酸钠(NaClO),次氯酸钠工业制法的反应原理是: 。某同学将Cl2通入185.8 g NaOH溶液中(NaOH过量),充分反应后得到混合溶液200g。计算:(计算结果精确到0.1%)(1)、参加反应的氯气质量是多少g。(2)、混合溶液中次氯酸钠的质量分数。(3)、84消毒液中起消毒作用的是次氯酸钠中的氯元素。已知某品牌84消毒液中起消毒作用的氯元素质量分数为6%,计算该84消毒液中次氯酸钠的质量分数。