江苏省苏州市常熟市2015-2016学年九年级下学期4月化学月考考试试卷
试卷更新日期:2017-10-09 类型:月考试卷
一、选择题
-
1. 联合国决定2011年为“国际化学年”,以纪念化学所取得的成就以及对人类文明的贡献为宗旨.下列提法不符合其宗旨的( )A、化学是一门创造新物质的科学,是自然科学中创造新物质最多的科学领域 B、普及化学知识,宣传化学贡献,提高公众科学素质 C、推广食用不含任何化学物质的绿色食品 D、让人们了解化学对社会作出的贡献,激发青少年学习化学的兴趣2. 下列常见生活用品中,所用材料属于有机合成材料的是( )A、铝合金门窗 B、制作快艇艇身玻璃钢 C、用于气体电子打火机的压电陶瓷 D、用来包装食品的聚乙烯薄膜3. 下列有关“化学之最”的叙述中,错误的是( )A、最简单的有机物是甲烷 B、相对分子质量最小的气体是氢气 C、地壳中含量最多是铝元素 D、天然存在最硬的物质是金刚石4. 下列物质可以用作食品抗氧化剂的是( )A、铁粉 B、炭粉 C、氯化钙 D、生石灰5. 下列有关水的知识,其中不正确的是( )A、水是一种最常见的溶剂,自然界中的水大多数含有杂质离子 B、水中Ca2+ . Mg2+的增多会引起水体的富营养化污染 C、用煮沸或蒸馏的方法能降低水的硬度 D、在水溶液中发生化学反应,反应速度比较快而且充分6. 下列各组物质中,前者属于单质、后者属于氧化物的是( )A、氢气 大理石 B、生铁 稀盐酸 C、氮气 蒸馏水 D、二氧化碳 空气7. 下列有关二氧化碳的实验中,只能证明二氧化碳物理性质的是( )A、
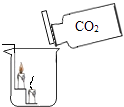 B、
B、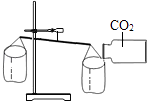 C、
C、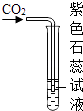 D、
D、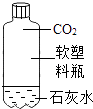 8. 下列物质的鉴别仅用加水的方法不能实现的是( )A、氯化钠和硝酸铵 B、氢氧化钠和氢氧化钙 C、碳酸钙和硫酸钡 D、浓硫酸和稀硫酸9. 从下列图示可以了解的信息中,其中不正确的是( )A、甲图是氟离子的结构示意图
8. 下列物质的鉴别仅用加水的方法不能实现的是( )A、氯化钠和硝酸铵 B、氢氧化钠和氢氧化钙 C、碳酸钙和硫酸钡 D、浓硫酸和稀硫酸9. 从下列图示可以了解的信息中,其中不正确的是( )A、甲图是氟离子的结构示意图 B、乙图中元素的原子核外有18个电子
B、乙图中元素的原子核外有18个电子 C、丁图表示钠元素显正一价
C、丁图表示钠元素显正一价 D、若“○”表示1个氧原子,则丙图表示两个氧原子
D、若“○”表示1个氧原子,则丙图表示两个氧原子 10. “瘦肉精”学名盐酸克伦特罗,化学式为C12H18Cl2N2O,食用含有“瘦肉精”的肉会对人体产生危害,下列对于瘦肉精认识不正确的是( )
10. “瘦肉精”学名盐酸克伦特罗,化学式为C12H18Cl2N2O,食用含有“瘦肉精”的肉会对人体产生危害,下列对于瘦肉精认识不正确的是( )
A、每个瘦肉精分子中含有35个原子 B、瘦肉精中碳元素的质量分数最大 C、瘦肉精的相对分子质量277g D、瘦肉精属于纯净物11. 下列有关溶液性质的说法中错误的是( )A、煮沸的咸汤比煮沸的水温度高 B、溶液一定是无色透明的 C、食盐水能导电是因为食盐水中含有较多自由移动的离子 D、消除路面上的积雪可以撒些盐,使冰雪较快融化12. 将日常生活中一些化学信息归纳成有趣的“三要点”,下列说法中有错误的是( )A、氢能源广泛推广有三大障碍:制取成本高、易泄漏贮存难、有毒 B、能提供热能的营养素有三种:蛋白质、油脂、糖类 C、我国古代流传至今的三大杰出化学工艺:造纸、制火药、烧瓷器 D、去油污的方法有三种:用汽油擦洗、用洗涤剂清洗、用热的碳酸钠溶液洗涤13. 下列实验操作能达到预期目的是( )A、用75mL酒精和25mL水配制100mL消毒酒精 B、用托盘天平称取10.58g碳酸钠粉末 C、用向上排空气法收集纯净的氢气 D、用10mL的量筒量取9.0mL水14. 日常生活中的下列做法,可行的是( )①食用酒精和工业酒精都可以作为饮料饮用
②由于淀粉遇到碘单质变蓝,可利用淀粉检验加碘食盐的真假
③喝牛奶、豆浆等富含蛋白质的食品可有效缓解重金属中毒现象
④低血糖病症发作时,吃馒头要比喝葡萄糖水见效快
⑤患有夜盲症的病人,多食用动物肝脏有利于视力恢复.
A、②③ B、③⑤ C、②⑤ D、①④15. 下列图象能正确反映其对应操作中各量变化关系的是( )A、向pH=3的稀盐酸中不断加水 B、向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B、向接近饱和的硝酸钾溶液中不断加入硝酸钾固体 C、高温煅烧一定质量的石灰石
C、高温煅烧一定质量的石灰石 D、在部分变质的NaOH溶液中加稀盐酸
D、在部分变质的NaOH溶液中加稀盐酸 16. 下列生产生活中的说法不合理的是( )A、用硫酸铜溶液和烧碱配制波尔多液 B、被酸雨污染的农田及湖泊可洒石灰粉末,减轻其危害 C、氨水(NH3•H2O)涂在蚊虫叮咬后的皮肤上,可减轻痛痒 D、新买衣服先用水清洗以除掉残留在衣物上用作防皱整理剂的甲醛17. 实验室用100g溶质质量分数20%的双氧水与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的是( )A、逐滴加入双氧水 B、加水稀释 C、减少双氧水的用量 D、降低温度18. 下列离子大量共存,且能形成无色溶液的是( )A、SO42﹣、Fe3+、Na+、OH﹣ B、K+、SO42﹣、Cu2+、NO3﹣ C、Cl﹣、K+、SO42﹣、Na+ D、Ca2+、Cl﹣、CO32﹣、Na+19. 下列实验操作正确的是( )A、加热试管中的溶液时,拇指按在试管夹的短柄上 B、用胶头滴管吸取氢氧化钠溶液时,在滴管伸入溶液前,要先捏紧胶头 C、配制10%的硫酸溶液时,在100mL量筒中加浓硫酸至10mL,再加水至100mL D、过滤时,将被过滤的液体沿玻璃棒注入漏斗,但玻璃棒不能靠在滤纸上20. 如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
16. 下列生产生活中的说法不合理的是( )A、用硫酸铜溶液和烧碱配制波尔多液 B、被酸雨污染的农田及湖泊可洒石灰粉末,减轻其危害 C、氨水(NH3•H2O)涂在蚊虫叮咬后的皮肤上,可减轻痛痒 D、新买衣服先用水清洗以除掉残留在衣物上用作防皱整理剂的甲醛17. 实验室用100g溶质质量分数20%的双氧水与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的是( )A、逐滴加入双氧水 B、加水稀释 C、减少双氧水的用量 D、降低温度18. 下列离子大量共存,且能形成无色溶液的是( )A、SO42﹣、Fe3+、Na+、OH﹣ B、K+、SO42﹣、Cu2+、NO3﹣ C、Cl﹣、K+、SO42﹣、Na+ D、Ca2+、Cl﹣、CO32﹣、Na+19. 下列实验操作正确的是( )A、加热试管中的溶液时,拇指按在试管夹的短柄上 B、用胶头滴管吸取氢氧化钠溶液时,在滴管伸入溶液前,要先捏紧胶头 C、配制10%的硫酸溶液时,在100mL量筒中加浓硫酸至10mL,再加水至100mL D、过滤时,将被过滤的液体沿玻璃棒注入漏斗,但玻璃棒不能靠在滤纸上20. 如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( ) A、t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液 B、t1℃时,50g甲的饱和溶液中有15g甲 C、t2℃时,甲、乙两物质溶液中溶质的质量分数相等 D、当甲中含有少量乙时,可以用降温结晶的方法提纯甲21. 如图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是( )
A、t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液 B、t1℃时,50g甲的饱和溶液中有15g甲 C、t2℃时,甲、乙两物质溶液中溶质的质量分数相等 D、当甲中含有少量乙时,可以用降温结晶的方法提纯甲21. 如图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是( ) A、此过程中有分解反应 B、此过程中S元素的化合价未发生改变 C、使用此废气处理装置可减少酸雨的形成 D、整个过程的反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2
A、此过程中有分解反应 B、此过程中S元素的化合价未发生改变 C、使用此废气处理装置可减少酸雨的形成 D、整个过程的反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2二、选择填充题
-
22. 在家中,小明取少量的下列物质分别放入水中,充分搅拌,其中能形成溶液的是( )A、面粉 B、蔗糖 C、芝麻糊 D、植物油23. 下列实验操作中,不正确的是( )A、加热液体
 B、稀释浓硫酸
B、稀释浓硫酸  C、蒸发食盐水
C、蒸发食盐水  D、检验装置的气密性
D、检验装置的气密性  24. 下列有关生产、环保、能源、资源问题的叙述错误的是( )A、pH<5.6的雨水称为酸雨 B、“温室效应”主要是由CO2等气体引起的 C、使用乙醇汽油能减少污染,节约石油资源 D、长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用25. 根据下面的实验过程和提供的数据,可知样品中碳的质量分数为( )
24. 下列有关生产、环保、能源、资源问题的叙述错误的是( )A、pH<5.6的雨水称为酸雨 B、“温室效应”主要是由CO2等气体引起的 C、使用乙醇汽油能减少污染,节约石油资源 D、长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用25. 根据下面的实验过程和提供的数据,可知样品中碳的质量分数为( ) A、44% B、46% C、54% D、64%
A、44% B、46% C、54% D、64%三、填空题
-
26. 生活中处处充满了化学.如图所示是医院常用的药瓶和注射器,请你据图中名称回答:
 (1)、属于金属材料的是(写一种即可,下同),属于有机合成材料是 .(2)、注射器洗净后可以用于家庭小实验,可以代替 仪器使用.(3)、钢针一般用不锈钢制造,硬度大且不容易生锈,钢和生铁的区别是含 的不同.27. 用化学方程式解释生活中的现象,并回答有关问题:(1)、运动会上的发令枪冒“白烟”: .(2)、“正常雨水”(不是酸雨)的pH<7,根据有关知识,解释原因: .(3)、用稀盐酸来除铁锈:;反应后溶液的颜色变化为色.(4)、用石灰乳(主要成分是熟石灰)来吸收二氧化硫气体: .(5)、某些工厂排放的废水中含有硫酸,可用氨水来除去:;该反应的类型是 .28. 某同学在实验室用高锰酸钾制取氧气,反应结束后,他想用反应的剩余物配制成一定质量分数的锰酸钾溶液(二氧化锰不溶于水),方法是先提纯后配制.
(1)、属于金属材料的是(写一种即可,下同),属于有机合成材料是 .(2)、注射器洗净后可以用于家庭小实验,可以代替 仪器使用.(3)、钢针一般用不锈钢制造,硬度大且不容易生锈,钢和生铁的区别是含 的不同.27. 用化学方程式解释生活中的现象,并回答有关问题:(1)、运动会上的发令枪冒“白烟”: .(2)、“正常雨水”(不是酸雨)的pH<7,根据有关知识,解释原因: .(3)、用稀盐酸来除铁锈:;反应后溶液的颜色变化为色.(4)、用石灰乳(主要成分是熟石灰)来吸收二氧化硫气体: .(5)、某些工厂排放的废水中含有硫酸,可用氨水来除去:;该反应的类型是 .28. 某同学在实验室用高锰酸钾制取氧气,反应结束后,他想用反应的剩余物配制成一定质量分数的锰酸钾溶液(二氧化锰不溶于水),方法是先提纯后配制.
(1)、以下实验步骤:①溶解、②计算、③过滤、④称量、⑤蒸发、⑥配制、⑦烘干,正确的操作顺序是 .
(2)、操作①、③、⑤中都用了玻璃棒,①中玻璃棒的作用是 , ③中玻璃棒的作用是 .(3)、若实验中锰酸钾不经干燥就直接配制溶液,则所配制的溶液中溶质质量分数将(填“偏大”、“偏小”或“不变”,下同).(4)、若用量筒量取水时,俯视液面,则所得溶液中溶质的质量分数将 .29. 分析处理图表中的信息是学习化学的一种重要方法.(1)、下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
①40℃时,氯化钠的溶解度为 g.
②碳酸钠的溶解度随温度的升高而(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是 (填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为 (计算结果精确到0.1%).
(2)、将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式 . 如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是 (填标号). 30. 如图装置适当组合可用于O2、H2、CO2等气体的制备和收集.
30. 如图装置适当组合可用于O2、H2、CO2等气体的制备和收集. (1)、仪器①的名称是 , 若A装置内药品为Zn和稀盐酸,反应的方程式 .(2)、B装置正放桌面,用于收集A生成的O2 , 则a接(选填“b“或“c“);若B装满水,用于收集A生成的H2 , 则a接(选填“b“或“c“).(3)、如果要制取和收集干燥的CO2 , 需要在A装置之后连接两个B装置,则在前一个B装置内加入的试剂是 .
(1)、仪器①的名称是 , 若A装置内药品为Zn和稀盐酸,反应的方程式 .(2)、B装置正放桌面,用于收集A生成的O2 , 则a接(选填“b“或“c“);若B装满水,用于收集A生成的H2 , 则a接(选填“b“或“c“).(3)、如果要制取和收集干燥的CO2 , 需要在A装置之后连接两个B装置,则在前一个B装置内加入的试剂是 .
31. 如图表示某些物质间转化关系.A、B为组成元素相同的无色液体,D是大理石的主要成分,C、F、H为气体,且H有刺激性气味. (1)、E的化学式为 .(2)、反应①的化学方程式为 .(3)、反应②的化学方程式为 .
(1)、E的化学式为 .(2)、反应①的化学方程式为 .(3)、反应②的化学方程式为 .由此反应可知,在农业生产中施用铵态氮肥时应注意 .
(4)、自然界中普遍存在着F转化为C的反应,名称为;工业生产中用F和H合成尿素,反应中F和H的质量比为 .32. 含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图1. (1)、粉碎的目的是 .(2)、若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、和 , 此处玻璃棒的作用是 .(3)、物质X是 , 滤渣中含有的金属单质有 , 除铜时发生的反应属于反应(填基本反应类型)(4)、流程中获得七水硫酸锌前省略的操作是、冷却结晶、、洗涤和低温烘干.(5)、某温度下,Fe(OH)3分解得到一种铁、氧质量比21:8的氧化物,该氧化物的化学式 .(6)、除铁过程中,温度、pH对除铁效果的影响分别对如图2所示.由图2可知,除铁时温度应控制在℃为宜,pH应控制在 . 为宜.
(1)、粉碎的目的是 .(2)、若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、和 , 此处玻璃棒的作用是 .(3)、物质X是 , 滤渣中含有的金属单质有 , 除铜时发生的反应属于反应(填基本反应类型)(4)、流程中获得七水硫酸锌前省略的操作是、冷却结晶、、洗涤和低温烘干.(5)、某温度下,Fe(OH)3分解得到一种铁、氧质量比21:8的氧化物,该氧化物的化学式 .(6)、除铁过程中,温度、pH对除铁效果的影响分别对如图2所示.由图2可知,除铁时温度应控制在℃为宜,pH应控制在 . 为宜.四、计算题
-
33. 某烧杯中盛有10%的Na2SO4溶液,向此烧杯中逐滴加入10%的BaCl2溶液至恰好不再产生沉淀为止.过滤,得到23.3克沉淀.将全部滤液蒸发掉一定量的水后,得到10%的NaCl溶液.求:(1)、10%的NaCl溶液的质量.(2)、蒸发掉的水的质量.