山东省潍坊市2020-2021学年高一上学期化学期中考试试卷
试卷更新日期:2020-11-27 类型:期中考试
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
-
1. 化学与生产、生活密切相关。下列说法错误的是:( )A、活性炭可用于净水 B、碳酸钠可用作糕点膨松剂 C、过氧化钠可用作呼吸面具供氧剂 D、氧化钙可用作食品干燥剂2. 下列关于金属钠和氯的叙述正确的是( )A、金属钠可以保存在石蜡油中 B、新制氯水中只含有Cl2和HClO两种分子 C、液氯、氯气和氯水是同一种物质 D、金属钠久置空气中最终变为碳酸氢钠3. 下列物质分类正确的是( )
选项
酸
碱
盐
酸性氧化物
A
NaHSO4
NaOH
CaCO3
NO2
B
H2SO4
Na2CO3
NH4Cl
SO2
C
CH3COOH
Ba(OH)2
CaCl2
CO
D
HNO3
KOH
NaHCO3
SO3
A、A B、B C、C D、D4. 化学是一门研究物质的组成、结构、性质、转化及其应用的科学。下列说法正确的是( )A、CaCl2、KCl在水中均易电离,且水溶液的导电能力相同 B、NaCl、CO2的水溶液均能导电,二者均属于电解质 C、Na2O、Na2O2均属于氧化物,都能与酸性氧化物CO2反应 D、Na2CO3、NaHCO3均属于可溶性盐,可用澄清石灰水鉴别5. 在无色透明的溶液中,能够大量共存的离子组是( )A、Al3+、Ca2+、Cl-、 B、Ag+、K+、 、Cl- C、Na+、Cu2+、 、 D、Na+、H+、 、6. 实验室用烧碱固体配制一定物质的量浓度的溶液。下列图示对应操作正确的是( )A、称量 B、转移
B、转移  C、定容
C、定容 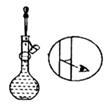 D、摇匀
D、摇匀  7. 下列实验现象描述正确的是( )A、氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 B、金属钠在氯气中燃烧,发出黄色火焰,产物溶于水产生无色气体 C、铁丝在氯气中燃烧,产生红棕色烟,产物溶于水得浅绿色溶液 D、铜在氯气中燃烧,产生棕黄色烟,产物溶于水得蓝绿色溶液8. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向稀硝酸中加入碳酸氢钠溶液: HCO3- +H+=CO2↑+H2O B、向CaCl2溶液中通CO2:Ca2++CO2+H2O=CaCO3↓+2H+ C、向粗盐中加入氢氧化钠溶液除去Mg2+:Mg2++2OH-=Mg(OH)2↓ D、将一小块钠投入水中:2Na+2H2O=2Na++2OH-+H2↑9. 在坩埚中放一小块钠加热,钠很快熔成圆球,停止加热,立即用玻璃棒蘸取少量无水CuSO4粉末与熔化的钠接触,产生耀眼的火花,并有轻微爆鸣声,同时有红色固体生成,经检验该红色固体与稀硫酸不反应。下列说法错误的是( )A、钠受热易熔成圆球说明其熔点低 B、钠与CuSO4粉末反应时放出大量热 C、将无水CuSO4粉末改为CuSO4溶液,反应现象相同 D、一定条件下,Na可以与CuSO4反应生成Cu10. 向一定浓度的Ba(OH)2溶液中滴加NaHSO4溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
7. 下列实验现象描述正确的是( )A、氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 B、金属钠在氯气中燃烧,发出黄色火焰,产物溶于水产生无色气体 C、铁丝在氯气中燃烧,产生红棕色烟,产物溶于水得浅绿色溶液 D、铜在氯气中燃烧,产生棕黄色烟,产物溶于水得蓝绿色溶液8. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向稀硝酸中加入碳酸氢钠溶液: HCO3- +H+=CO2↑+H2O B、向CaCl2溶液中通CO2:Ca2++CO2+H2O=CaCO3↓+2H+ C、向粗盐中加入氢氧化钠溶液除去Mg2+:Mg2++2OH-=Mg(OH)2↓ D、将一小块钠投入水中:2Na+2H2O=2Na++2OH-+H2↑9. 在坩埚中放一小块钠加热,钠很快熔成圆球,停止加热,立即用玻璃棒蘸取少量无水CuSO4粉末与熔化的钠接触,产生耀眼的火花,并有轻微爆鸣声,同时有红色固体生成,经检验该红色固体与稀硫酸不反应。下列说法错误的是( )A、钠受热易熔成圆球说明其熔点低 B、钠与CuSO4粉末反应时放出大量热 C、将无水CuSO4粉末改为CuSO4溶液,反应现象相同 D、一定条件下,Na可以与CuSO4反应生成Cu10. 向一定浓度的Ba(OH)2溶液中滴加NaHSO4溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是( ) A、ab段发生反应的离子方程式是Ba2++ =BaSO4↓ B、bc段发生反应的离子方程式是Ba2++OH-+H++ =BaSO4↓+H2O C、c点溶液中大量存在的离子是Na+、 D、b、d两点对应溶液中的离子总数目相等
A、ab段发生反应的离子方程式是Ba2++ =BaSO4↓ B、bc段发生反应的离子方程式是Ba2++OH-+H++ =BaSO4↓+H2O C、c点溶液中大量存在的离子是Na+、 D、b、d两点对应溶液中的离子总数目相等二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
-
11. 下列实验操作、现象和结论均正确的是( )
选项
实验操作、现象
结论
A
将盛有新制氢氧化铁胶体的半透膜袋浸入盛有蒸馏水的烧杯中,一段时间后向烧杯中滴加AgNO3溶液,产生白色沉淀
胶体微粒能够透过半透膜
B
某溶液加入稀盐酸无明显现象,再滴加BaCl2溶液,有白色沉淀生成
确定该溶液中存在
C
盛满氯气的试管倒扣在水槽中,静置一段时间后,试管中液面上升一段距离
氯气能溶于水
D
用小刀切割金属钠,钠表面光亮的银白色迅速变暗
金属钠质软,易与水反应生成NaOH
A、A B、B C、C D、D12. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4L空气中含有的单质分子数为NA B、标准状况下,2.24L乙醇中含有的氢原子数是0.6NA C、常温常压下,14g由N2与CO组成的混合气体中含有的原子数为NA D、常温下,2L0.5 mol·L-1Na2CO3溶液中含有的Na+数为2NA13. 某地区的雾霾中可能含有Na+、Ba2+、Mg2+、Fe3+、 、Cl-、 、 等离子。某同学收集雾霾样品,经必要的预处理配成试样溶液,设计如下实验探究其中含有的离子。①取一定体积的溶液, 加人足量BaCl2溶液,产生白色沉淀,继续滴加足量盐酸,沉淀不溶解,同时得到无色气体。
②另取一定体积的溶液,加人足量NaOH溶液,产生白色沉淀,继续滴加足量稀盐酸,沉淀全部溶解。下列判断错误的是( )
A、操作①中产生的无色气体为CO2 B、可能含有 C、肯定含有Mg2+、 、 D、一定不存在Ba2+、Fe3+、Cl-14. 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现无色、浅黄绿色、红色等变化。
下列叙述正确的是( )
A、过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+ B、过程Ⅱ溶液由红色变成无色,证明试管②溶液不再呈酸性 C、过程Ⅲ溶液颜色由无色变成浅黄绿色,证明溶液中有Cl2 D、若向紫色石蕊试液中持续加入Na2O2粉末,也会出现相同的颜色变化15. 某无土栽培用营养液中含有KCl、K2SO4、NH4Cl三种溶质,实验测得部分离子的浓度如图甲表示。取200mL样品加水稀释,测得 的浓度(c)随溶液体积(V)的变化如图乙曲线表示。
下列判断错误的是( )
A、图甲中X离子是 B、图乙中c1=8.0 C、营养液中NH4Cl与K2SO4的物质的量之比为2:1 D、营养液中KCl的浓度是4mol·L-1三、非选择题:本题共5小题,共60分。
-
16. 84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。
84消毒液
[有效成分] NaClO
[规格] 1000mL
[质量分数] 25%
[密度] 1.192g·cm-3
回答下列问题:
(1)、工业上常用氯气与烧碱溶液反应制取84消毒液,写出反应的离子方程式。(2)、84消毒液使用时需要稀释。某化学实验小组用上述84消毒液配制480mL0.2mol·L-1的稀溶液。①量取84消毒液mL。
②洗涤时需要将仪器(填名称)洗涤2~3次。
③定容时加蒸馏水不慎超过了刻度线,此时应采取的处理方法是;该小组同学用量筒量取84消毒液时,仰视观察液面,所配溶液的浓度会(填“偏高”、“偏低”或“无影响")。
(3)、向84消毒液中加入少量稀硫酸可以增强漂白消毒效果,请解释其原因(用化学方程式回答)。17. 氯气广泛应用于杀菌、消毒及化工领域。某化学实验小组设计如图装置制取氯气,并探究其化学性质
已知:①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
②氯气易溶于CCl4等有机溶剂
回答下列问题:
(1)、仪器a的名称是。(2)、D处收集纯净氯气,观察其物理性质。①推测装置B的作用是 , 裝置C中的试剂是(填名称)。
②D处装置可选用(填序号)。
 (3)、能够证明氯气跟水发生反应的现象是。(4)、装置G中溶液的红色逐渐褪去而得到无色溶液。小组同学认为溶液红色褪去的原因可能有两种,一种是氯气与水反应产生HClO具有漂白性,使红色褪去;另一种是(请用简要文字回答)。18. 学习小组利用如下流程制备过氧化钠,并设计实验验证其相关性质。
(3)、能够证明氯气跟水发生反应的现象是。(4)、装置G中溶液的红色逐渐褪去而得到无色溶液。小组同学认为溶液红色褪去的原因可能有两种,一种是氯气与水反应产生HClO具有漂白性,使红色褪去;另一种是(请用简要文字回答)。18. 学习小组利用如下流程制备过氧化钠,并设计实验验证其相关性质。
回答下列问题:
(1)、金属钠被氧化失去金属光泽,颜色变为 。(2)、流程中生成淡黄色固体的化学方程式为。(3)、小组同学取一定量淡黄色固体溶于冷水中,待固体全部反应后,仍可缓慢释放氧气。为探究固体溶解后溶液成分,设计如下实验方案进行验证:
①甲中产生较多气泡,证明固体溶解后溶液中有(填化学式),写出甲中发生反应的化学方程式。
②向乙中滴入酚酞,溶液变红的原因是(用电离方程式回答)。
(4)、小组同学将金属钠加热至熔化后,误通入了干燥的CO2进行反应,将反应后固体产物溶于稀盐酸,产生气泡,观察到难溶于水的黑色固体。①产物中与盐酸反应的物质可能为(填化学式)。
②经检验,黑色固体为单质碳。写出CO2与Na反应的化学方程式。
19. 化学小组欲从含CuCl2、NaCl及少量K2SO4的混合溶液中分离出CuCl2和NaCl,设计实验流程如下:
已知:氯化钠、氯化钾在不同温度下的溶解度如下表所示:
温度/℃
0
20
40
60
80
100
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
KCl
27.6
34.0
40.0
45.5
51.1
56.7
回答下列问题:
(1)、试剂甲、乙分别是、。(2)、向滤渣中加入试剂丙后发生反应的离子方程式是。(3)、操作1的名称是 。(4)、操作2包括蒸发结晶、过滤等过程。实验时需在结晶后趁热完成过滤的目的是 , 过滤时应首先进行的操作是。(5)、取操作2所得氯化钠晶体少许溶于酒精,得乳白色液体,用一束可见光照射液体,若在人射光的侧面观察到 , 则证明所得液体为胶体。20. 侯德榜是我国杰出的化学家,创立了中国人自己的制碱工艺——侯氏制碱法。实验室模拟侯氏制碱法的工艺流程如图所示。
回答下列问题:.
(1)、实验室制备CO2的离子方程式为。(2)、NaCl、NH3、CO2和水反应有两种新物质生成,其中一种是NH4Cl。步骤Ⅱ发生反应的化学方程式为。(3)、写出步骤Ⅳ发生反应的化学方程式。(4)、检验产品中是否含有氯化钠,应该选用的试剂是。(5)、常温下NaCl的溶解度为36g,饱和溶液的密度为1.12g·cm-3 , 该溶液的物质的量浓度为mol·L-1(结果保留整数),反应中消耗饱和食盐水V mL,制得纯碱mg,NaCl的利用率为(用含V、m的代数式回答)。