浙江省衢州市2020-2021学年九年级上学期科学期中检测试卷(1.1-3.3)
试卷更新日期:2020-11-27 类型:期中考试
一、选择题(本题有15小题,每小题4分,共60分。每小题只有一个选项是正确的,不选、多选、错选均不给分)
-
1. 新冠肺炎疫情爆发已构成一次全球性“大流行”。在抗击新冠肺炎疫情的下列做法中,一定发生化学变化的是( )A、佩戴口罩 B、保持通风 C、杀菌消毒 D、勤洗手2. 对下列物质俗称的理解错误的是( )A、纯碱不是碱 B、水银不是银 C、干冰不是冰 D、食盐不是盐3. 诺贝尔化学奖研究理论有助于化学家合成开发出更多更复杂的有机物。生活中的下列物质不属于有机物是( )A、醋酸(CH3COOH) B、、食盐(NaCl) C、酒精(C2H5OH) D、甲烷(CH4)4. 下列实验操作中正确的是( )A、干燥氧气
 B、稀释浓硫酸
B、稀释浓硫酸  C、pH试纸测酸碱性
C、pH试纸测酸碱性  D、往试管内放锌粒
D、往试管内放锌粒  5. 我国科研人员以CCl4和金属钠为原料在700℃时制造出纳米级金刚石粉末,被科学家们高度评价为“稻草变黄金”,反应方程式为4Na+CCl4 C+4NaCl,该反应属于( )A、复分解反应 B、置换反应 C、化合反应 D、分解反应6. 能量形式多种多样,下列有关物体具备的能量描述错误的是( )A、风具有风能
5. 我国科研人员以CCl4和金属钠为原料在700℃时制造出纳米级金刚石粉末,被科学家们高度评价为“稻草变黄金”,反应方程式为4Na+CCl4 C+4NaCl,该反应属于( )A、复分解反应 B、置换反应 C、化合反应 D、分解反应6. 能量形式多种多样,下列有关物体具备的能量描述错误的是( )A、风具有风能 B、奔跑的豹有动能
B、奔跑的豹有动能  C、食物中有化学能
C、食物中有化学能  D、跳水运动员有弹性势能
D、跳水运动员有弹性势能  7. 2020年5月,我市研发出7μm超薄铜箔,该项技术全国领先。铜能加工成铜箔是利用铜的( )A、导电性 B、延展性 C、可燃性 D、抗腐蚀性8. 氮肥能促进植物茎、叶生长茂盛,提高蛋白质含量。下列化肥中属于氮肥的是( )A、CO(NH2)2 B、Ca3(PO4)2 C、NH4H2PO4 D、K2SO49. 科学概念在逻辑上存在包含关系、并列关系、交叉关系,下列概念不属于包含关系的是( )
7. 2020年5月,我市研发出7μm超薄铜箔,该项技术全国领先。铜能加工成铜箔是利用铜的( )A、导电性 B、延展性 C、可燃性 D、抗腐蚀性8. 氮肥能促进植物茎、叶生长茂盛,提高蛋白质含量。下列化肥中属于氮肥的是( )A、CO(NH2)2 B、Ca3(PO4)2 C、NH4H2PO4 D、K2SO49. 科学概念在逻辑上存在包含关系、并列关系、交叉关系,下列概念不属于包含关系的是( ) A、化合物与盐 B、化合物与单质 C、化合物与氧化物 D、纯净物与化合物10. 材料是时代进步的重要标志。下列有关材料的说法中错误的是( )A、废弃塑料会带来“白色污染” B、铝表面致密氧化膜防止铝制品被酸腐蚀 C、指甲、羊毛里含有蛋白质 D、塑料、合成橡胶都属于有机合成材料11. 实验室中一瓶浓盐酸敞口放置一定时间,下列四幅图,能正确反映其变化关系的是( )A、
A、化合物与盐 B、化合物与单质 C、化合物与氧化物 D、纯净物与化合物10. 材料是时代进步的重要标志。下列有关材料的说法中错误的是( )A、废弃塑料会带来“白色污染” B、铝表面致密氧化膜防止铝制品被酸腐蚀 C、指甲、羊毛里含有蛋白质 D、塑料、合成橡胶都属于有机合成材料11. 实验室中一瓶浓盐酸敞口放置一定时间,下列四幅图,能正确反映其变化关系的是( )A、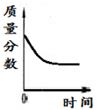 B、
B、 C、
C、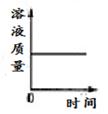 D、
D、 12. 实验室有三瓶失去标签的无色溶液,分别是HCl、NaCl、BaCl2的溶液。欲使它们一次鉴别出来,可选用的试剂是( )A、Na2CO3 B、AgNO3 C、H2SO4 D、Ca(OH)213. 为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是( )
12. 实验室有三瓶失去标签的无色溶液,分别是HCl、NaCl、BaCl2的溶液。欲使它们一次鉴别出来,可选用的试剂是( )A、Na2CO3 B、AgNO3 C、H2SO4 D、Ca(OH)213. 为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是( )选项
物 质
选用试剂
操作方法
A
NaOH溶液( Na2CO3)
氯化钙溶液
加入足量的氯化钙溶液,充分反应后过滤
B
Cu(Fe)
稀盐酸
加入足量稀盐酸,充分反应后过滤、洗涤
C
CuSO4溶液(HCl)
氧化铜
加入足量的氧化铜粉末,充分反应后过滤
D
盐酸(H2SO4)
硝酸钡溶液
加入足量的硝酸钡溶液,充分反应后过滤
A、A B、B C、C D、D14. 将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,充分反应后过滤。向滤渣中加入足量的稀盐酸,无现象。则滤渣中( )A、一定有银,可能有铜和锌 B、一定有银,可能有铜,一定没有锌 C、一定有银和铜,可能有锌 D、一定有银和铜,一定没有锌15. 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸溶液。下列能正确反映其对应变化关系的是( )A、 B、
B、 C、
C、 D、
D、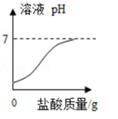
二、填空题(本题有7小题,每空2分,共40分)
-
16. 请从 H、O、Ca、C、Cl、Na 中选择合适的元素,按下列要求写出一种物质的化学式。(1)、厨房常用的调味品是:;(2)、碳酸饮料所释放出的气体是:;(3)、农业上用来降低土壤酸性的是:。17. 如图是小明对常见化合物的分类整理。
 (1)、甲处应填写的物质类型是;(2)、小明将硫酸、碳酸归为酸,其分类标准是:;(3)、小明的分类整理中有种物质归类错误,这种物质是。18. 酸碱性与我们的生活、健康密切相关。(1)、酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即PH7。(填“大于”或“等于”或“小于”)(2)、人长时间忧虑、哭喊时呼吸变快变浅易引起呼吸碱中毒,该过程二氧化碳过度排出,使血液的pH。(填“升高”或“降低”)19. 2020年6月23日,我国最后一颗北斗三号卫星发射成功,即完成北斗导航卫星全球组网,这标志着我国乃至国外即可彻底摆脱依赖美国的GPS卫星定位系统。
(1)、甲处应填写的物质类型是;(2)、小明将硫酸、碳酸归为酸,其分类标准是:;(3)、小明的分类整理中有种物质归类错误,这种物质是。18. 酸碱性与我们的生活、健康密切相关。(1)、酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即PH7。(填“大于”或“等于”或“小于”)(2)、人长时间忧虑、哭喊时呼吸变快变浅易引起呼吸碱中毒,该过程二氧化碳过度排出,使血液的pH。(填“升高”或“降低”)19. 2020年6月23日,我国最后一颗北斗三号卫星发射成功,即完成北斗导航卫星全球组网,这标志着我国乃至国外即可彻底摆脱依赖美国的GPS卫星定位系统。 (1)、北斗三号卫星升空过程中重力势能(选填“变大”、“不变”或“变小”)。(2)、卫星沿轨道绕地球运行时,在近地点的速较大,在远地点的速度较小,则卫星从近地点运动到远地点的过程中动能会(填“变大”或“变小”)20. 室温下,将稀盐酸慢慢滴入滴有酚酞的氢氧化钠溶液中,利用温度计测出溶液的温度随加入的稀盐酸质量而发生的变化,如图所示。
(1)、北斗三号卫星升空过程中重力势能(选填“变大”、“不变”或“变小”)。(2)、卫星沿轨道绕地球运行时,在近地点的速较大,在远地点的速度较小,则卫星从近地点运动到远地点的过程中动能会(填“变大”或“变小”)20. 室温下,将稀盐酸慢慢滴入滴有酚酞的氢氧化钠溶液中,利用温度计测出溶液的温度随加入的稀盐酸质量而发生的变化,如图所示。 (1)、由图示可知,稀盐酸与氢氧化钠溶液的反应是(填“吸热”、“放热”)反应;(2)、B处溶液的溶质是;(3)、在C点可观察到的现象是;(4)、在D处溶液里滴加AgNO3溶液,出现白色沉淀,即可推断稀盐酸已过量,请判断该推断是否合理并说明理由。21. 铁是生产生活中应用最广泛的一种金属。
(1)、由图示可知,稀盐酸与氢氧化钠溶液的反应是(填“吸热”、“放热”)反应;(2)、B处溶液的溶质是;(3)、在C点可观察到的现象是;(4)、在D处溶液里滴加AgNO3溶液,出现白色沉淀,即可推断稀盐酸已过量,请判断该推断是否合理并说明理由。21. 铁是生产生活中应用最广泛的一种金属。 (1)、硬币要求具备耐磨性好、抗腐蚀性好等优点。2019年版5角硬币的材质就已换到钢芯镀镍合金,它的硬度比纯铁(填“大”或“小”);(2)、铁铸币易锈蚀,小明取三枚相同已打磨过的铁钉,设计了如图实验探究铁生锈的条件。经过较长时间后,观察到A试管中铁钉生锈,B、C试管中铁钉不生锈。通过上述实验现象分析,可得出铁生锈的外部条件是;(3)、为了防止铁制品生锈,可采用的方法是(写出一 种即可)。22. 酒精灯是实验室常备仪器。某科学小组同学用下列提供的仪器、装置设计实验方案,探究酒精(C2H6O)在氧气中燃烧的产物,燃烧后混合气体可能有二氧化碳、水、一氧化碳中的一种或几种。
(1)、硬币要求具备耐磨性好、抗腐蚀性好等优点。2019年版5角硬币的材质就已换到钢芯镀镍合金,它的硬度比纯铁(填“大”或“小”);(2)、铁铸币易锈蚀,小明取三枚相同已打磨过的铁钉,设计了如图实验探究铁生锈的条件。经过较长时间后,观察到A试管中铁钉生锈,B、C试管中铁钉不生锈。通过上述实验现象分析,可得出铁生锈的外部条件是;(3)、为了防止铁制品生锈,可采用的方法是(写出一 种即可)。22. 酒精灯是实验室常备仪器。某科学小组同学用下列提供的仪器、装置设计实验方案,探究酒精(C2H6O)在氧气中燃烧的产物,燃烧后混合气体可能有二氧化碳、水、一氧化碳中的一种或几种。 (1)、为检验酒精燃烧后生成的混合气体成分,上述装置的连接顺序应该是:燃烧后混合气体→D→B→C→→B→尾气处理。(填装置编号,可重复使用)(2)、C装置在该实验中的作用是。(3)、科学小组同学将酒精燃烧后生成的混合气体,按正确设计方案及操作顺序进行实验,发现A、B、D装置中物质均出现明显现象,从而确定酒精燃烧产物一定有。
(1)、为检验酒精燃烧后生成的混合气体成分,上述装置的连接顺序应该是:燃烧后混合气体→D→B→C→→B→尾气处理。(填装置编号,可重复使用)(2)、C装置在该实验中的作用是。(3)、科学小组同学将酒精燃烧后生成的混合气体,按正确设计方案及操作顺序进行实验,发现A、B、D装置中物质均出现明显现象,从而确定酒精燃烧产物一定有。三、实验探究题(本题有4小题,第25(2)题6分,其余每空3分,共36分)
-
23. 为了探究“物体的动能与质量是否有关”,小明利用如图所示装置进行实验:
①让一实心铁球从该斜面的A点静止释放,使实心铁球沿斜面滚下,并撞击水平桌面上的橡皮泥,观察并测量相关实验数据。
②更换材质、大小、厚度相同的橡皮泥,让不同质量的实心铁球重复上述步骤。
③多次重复实验,得出结论。
 (1)、实验中,通过测量来间接反映铁球动能的大小。(2)、请指出小明实验方案存在的不足之处。(3)、利用上述实验装置,还可以探究的问题是。24. 某科学兴趣小组把金属钠放到硫酸铜溶液中,发现没有红色的铜析出。为了验证钠究竟能否置换硫酸铜溶液中的铜,查阅资料并展开了探究性实验。
(1)、实验中,通过测量来间接反映铁球动能的大小。(2)、请指出小明实验方案存在的不足之处。(3)、利用上述实验装置,还可以探究的问题是。24. 某科学兴趣小组把金属钠放到硫酸铜溶液中,发现没有红色的铜析出。为了验证钠究竟能否置换硫酸铜溶液中的铜,查阅资料并展开了探究性实验。【查阅资料】
①常温下钠能与水发生反应生成氢气和氢氧化钠,并放出大量热:2Na+2H2O=2NaOH+ H2↑△
②氢氧化铜受热会分解成氧化铜和水:Cu(OH)2==CuO+ H2O△
③氢气还原氧化铜不充分时会先还原成氧化亚铜:2CuO+H2 == Cu2O+H2O
④氧化亚铜是红色粉末,几乎不溶于水,能与酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O
⑤铜在粉末状态时呈黑色
【实验探究】
取几块绿豆大小的钠块分别用锡箔纸(扎有若干小孔)包住,再分别放入足量且等量的不同浓度、不同温度的CuSO4溶液中,实验现象如下表:
实验组别 CuSO4溶液浓度 CuSO4溶液温度(℃) 锡箔纸正面 1 5% 18 有等量蓝色、黑色物质 2 5% 30 有等量蓝色、黑色物质,少量红色物质 3 5% 40 有较多蓝色物质,少量黑色物质 4 10% 18 有大量蓝色物质、红色物质 5 10% 30 有大量蓝色物质、红色物质 (1)、本实验探究钠与硫酸铜溶液反应是否产生铜的影响因素有。(2)、经检验,实验1中生成的黑色物质是氧化铜。结合所学知识与材料,解释其产生的原因。。(3)、实验中有红色物质生成,有同学认定该物质是铜,也有同学认为其可能是氧化亚铜。为了验证该红色物质是铜,请设计实验方案。25. 铁在不同环境条件下锈蚀的快慢不同。为了比较铁在不同酸性环境中锈蚀的快慢,科学兴趣小组利用如图所示装置进行实验探究。
可选用的器材:铁粉、溶质质量分数为7.3%的盐酸、蒸馏水、烧杯、量筒、托盘天平。
建议:铁粉可装入纱布吊袋内;每组宜取10mL盐酸溶液;每组实验时间不超过1周。
实验步骤:
①利用提供的盐酸和蒸馏水,配置溶质质量分数为3.65%的盐酸
②检查装置气密性;
……
(1)、写出步骤①中所需要的测量工具。(2)、补充完整实验步骤②之后的其它步骤。。26. 二氧化碳能溶于水,且二氧化碳与氢氧化钠反应时无明显现象。为了直观、定量地说明二氧化碳通入氢氧化钠溶液是与氢氧化钠反应的事实,小明查阅了如下资料并进行实验。【查阅资料】
①15℃、1标准大气压时,二氧化碳的溶解度见下表:
溶剂
水
酒精
溶解度/(ml/mL)
1.0
0.3
②通常情况下,稀溶液的体积约等于溶剂的体积。
【实验探究】
如图所示,在一锥形瓶中收集15℃、1标准大气压的二氧化碳114毫升,将滴管中7毫升氢氧化钠溶液全部加入锥形瓶,观察到注射器活塞向左移动并将酒精推入锥形瓶内。
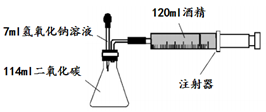 (1)、实验前要检查装置气密性:向左缓缓推动注射器活塞,若气密性良好,放手后可观察到。(2)、实验前注射器内酒精体积为120毫升,实验结束时,注射器中剩余酒精体积为20毫升,则与氢氧化钠反应的二氧化碳体积为毫升。(忽略酒精与水混合后的体积减小量)(3)、实验中120毫升酒精不能换成水,原因是。
(1)、实验前要检查装置气密性:向左缓缓推动注射器活塞,若气密性良好,放手后可观察到。(2)、实验前注射器内酒精体积为120毫升,实验结束时,注射器中剩余酒精体积为20毫升,则与氢氧化钠反应的二氧化碳体积为毫升。(忽略酒精与水混合后的体积减小量)(3)、实验中120毫升酒精不能换成水,原因是。四、解答题(本题有6小题,第27题6分,28题5分,29题8分,30题8分,31题8分,32题9分,共44分)
-
27. 某固体可能由Na2SO4 、NaCl、 Na2CO3 、KNO3中的一种或几种组成,为检验其成分进行如下实验:
 (1)、操作Ⅰ中需要用到下列器材中的(可多选)。
(1)、操作Ⅰ中需要用到下列器材中的(可多选)。 (2)、白色沉淀A的化学式为。(3)、原固体中一定不含有。28. 电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。小明将某Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器(如图1),往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的导电率变化如图2所示。请结合材料信息和所学知识,对甲乙两条曲线变化的原因作出合理解释。
(2)、白色沉淀A的化学式为。(3)、原固体中一定不含有。28. 电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。小明将某Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器(如图1),往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的导电率变化如图2所示。请结合材料信息和所学知识,对甲乙两条曲线变化的原因作出合理解释。 29. 小明买了一瓶钙片,但说明书某些地方模糊不清,于是拿到实验室做了探究:取2片钙片样品研磨后放在烧杯里,加入50g盐酸溶液,两者恰好完全反应(假设钙片中其他成分不与盐酸溶液反应),测得烧杯中剩余物质的总质量(m)与反应时间(t)的关系如图所示。
29. 小明买了一瓶钙片,但说明书某些地方模糊不清,于是拿到实验室做了探究:取2片钙片样品研磨后放在烧杯里,加入50g盐酸溶液,两者恰好完全反应(假设钙片中其他成分不与盐酸溶液反应),测得烧杯中剩余物质的总质量(m)与反应时间(t)的关系如图所示。

 (1)、将钙片研磨的目的是。(2)、反应后产生气体的质量 g。(3)、试通过计算求每片钙片中碳酸钙的含量30. 实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,其化学方程式为:
(1)、将钙片研磨的目的是。(2)、反应后产生气体的质量 g。(3)、试通过计算求每片钙片中碳酸钙的含量30. 实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,其化学方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓。现有100克碳酸钠溶液,将150克氯化钙溶液分4次
加入,充分反应,测量所得数据如下表所示:
次数
第1次
第2次
第3次
第4次
加入氯化钙溶液的质量/克
40
40
40
30
所得溶液的总质量/克
134
168
202
232
(1)、恰好完全反应时,生成沉淀的总质量为克。(2)、第4次实验结束后,所得溶液中的溶质有(填化学式)。(3)、求氯化钙溶液的溶质质量分数。(写出计算过程)31. 赤铁矿石的主要成分是氧化铁。小明取干燥赤铁矿石样品15g,用如图所示实验来测定其中氧化铁的质量(矿石中的杂质不发生化学变化),氧化铁与氢气反应的化学方程式为:Fe2O3+3H2 2Fe+3H2O。
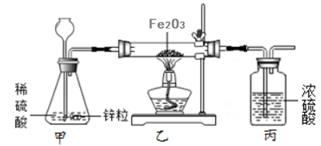 (1)、实验时,加热前要先通一会儿氢气,其目的是。(2)、完全反应后,继续通入氢气直至乙装置完全冷却。小明测得丙装置反应前后质量增加3.6g,则该赤铁矿石样品中氧化铁的质量有多少?(计算结果保留至小数点后一位)(3)、其他同学认为小明的方式会导致氧化铁质量分测量结果存在误差,比较测量值与真实值的大小关系并说明理由:。32. 科学兴趣小组探究金属的性质时,将24g相同表面积的镁铜合金,均分成两等份,分别滴加体积相同、溶质质量分数不同的稀盐酸,在一定条件下反应,测得气压变化如图甲所示。
(1)、实验时,加热前要先通一会儿氢气,其目的是。(2)、完全反应后,继续通入氢气直至乙装置完全冷却。小明测得丙装置反应前后质量增加3.6g,则该赤铁矿石样品中氧化铁的质量有多少?(计算结果保留至小数点后一位)(3)、其他同学认为小明的方式会导致氧化铁质量分测量结果存在误差,比较测量值与真实值的大小关系并说明理由:。32. 科学兴趣小组探究金属的性质时,将24g相同表面积的镁铜合金,均分成两等份,分别滴加体积相同、溶质质量分数不同的稀盐酸,在一定条件下反应,测得气压变化如图甲所示。 (1)、对比图甲中a、b曲线,引起a曲线压强增大速度明显快于b的因素可能是。(列举一点即可)(2)、其中有一组实验是滴加7.3%稀盐酸,产生氢气的质量随加入盐酸的质量变化情况如图乙所示。①图乙中当刚好生成0.4g氢气时,所得溶液中溶质的质量分数为多少?(计算结果保留至 0.1%)②将图乙中C点对应的溶液过滤,向滤液中逐滴加入过量氢氧化钠溶液。在图丙中标出生氢氧化镁沉淀质量随滴加氢氧化钠质量的大致变化曲线。(图中不需注明具体相关质量)
(1)、对比图甲中a、b曲线,引起a曲线压强增大速度明显快于b的因素可能是。(列举一点即可)(2)、其中有一组实验是滴加7.3%稀盐酸,产生氢气的质量随加入盐酸的质量变化情况如图乙所示。①图乙中当刚好生成0.4g氢气时,所得溶液中溶质的质量分数为多少?(计算结果保留至 0.1%)②将图乙中C点对应的溶液过滤,向滤液中逐滴加入过量氢氧化钠溶液。在图丙中标出生氢氧化镁沉淀质量随滴加氢氧化钠质量的大致变化曲线。(图中不需注明具体相关质量)