山东省威海市环翠区威海环翠国际2020-2021学年九年级上学期化学第一次月考试卷
试卷更新日期:2020-11-26 类型:月考试卷
一、单选题
-
1. 分类法是化学学习的重要方法之一。下列各组物质按照单质、盐、混合物的顺序排列的是( )A、生铁、氢氧化铜、冰水混合物 B、液氧、硫酸钡、粗盐 C、天然气 纯碱、石油 D、钙 片、氯化镁、海水2. 某混合物其组成特点是“各成分彼此完全混合,处处相同”,这种混合物不可能是( )A、食盐水 B、黄泥水 C、空气 D、不锈钢3. 75%的医用酒精(是指每100体积的医用酒精中含75体积的乙醇)可以杀死新型冠状病毒,下列说法错误的是( )A、该医用酒精中的溶剂是水 B、该医用酒精是均一的,稳定的 C、100g该医用酒精中含乙醇75g D、乙醇和水混合后的体积小于二者体积之和4. 用如图装置进行实验,将装置倾斜,使管①、②中药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符合该实验现象的是( )
 A、固体氢氧化钠和水 B、硝酸铵和水 C、镁条和稀盐酸 D、大理石和稀盐酸5. 煮鱼时加些酒,能使甲胺溶于乙醇并随加热后挥发逸去,经过这样烹饪的鱼就不再有腥味了。下列过程与上面所述原理不相似的是 ( )A、用洗涤剂洗碗 B、用水除去衣服上的汗渍 C、用汽油除去衣服上的油污 D、用酒精将试管壁上的碘洗掉6. 用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )A、量筒、烧杯、漏斗、玻璃棒 B、托盘天平、玻璃棒、药匙、烧杯 C、托盘天平、玻璃棒、量筒、烧杯 D、玻璃棒、量筒、烧杯、胶头滴管7. 在20℃时,刘冰同学向100g水中依次加入NaCl固体,充分溶解。实验过程如图所示,下列说法错误的是( )
A、固体氢氧化钠和水 B、硝酸铵和水 C、镁条和稀盐酸 D、大理石和稀盐酸5. 煮鱼时加些酒,能使甲胺溶于乙醇并随加热后挥发逸去,经过这样烹饪的鱼就不再有腥味了。下列过程与上面所述原理不相似的是 ( )A、用洗涤剂洗碗 B、用水除去衣服上的汗渍 C、用汽油除去衣服上的油污 D、用酒精将试管壁上的碘洗掉6. 用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )A、量筒、烧杯、漏斗、玻璃棒 B、托盘天平、玻璃棒、药匙、烧杯 C、托盘天平、玻璃棒、量筒、烧杯 D、玻璃棒、量筒、烧杯、胶头滴管7. 在20℃时,刘冰同学向100g水中依次加入NaCl固体,充分溶解。实验过程如图所示,下列说法错误的是( )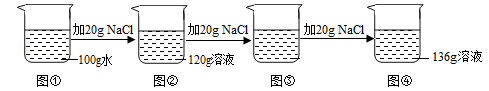 A、20℃时,NaCl的溶解度为36g B、图③中溶液的溶质质量为40g C、图③中的溶液是饱和溶液 D、图③和图④中NaCl溶液的溶质质量分数相等8. 下列物质属于酸的是( )A、CH3COOH B、SO2 C、NH3∙H2O D、NaHCO39. 下列变化中有一种变化与其它三种变化不同的是( )A、浓盐酸打开瓶塞,瓶口形成白雾 B、浓硫酸敞口放置,溶液质量增加 C、盛石灰水的试剂瓶壁产生一层白膜 D、滴有酸酞的氢氧化钠溶液中加入木炭后红色消失10. 两瓶标签损毁的溶液分别是稀盐酸、稀硫酸,下列试剂中能够用来区分两种溶液的是. ( )A、锌粒 B、氯化钡溶液 C、紫色石蕊溶液 D、氢氧化钠溶液
A、20℃时,NaCl的溶解度为36g B、图③中溶液的溶质质量为40g C、图③中的溶液是饱和溶液 D、图③和图④中NaCl溶液的溶质质量分数相等8. 下列物质属于酸的是( )A、CH3COOH B、SO2 C、NH3∙H2O D、NaHCO39. 下列变化中有一种变化与其它三种变化不同的是( )A、浓盐酸打开瓶塞,瓶口形成白雾 B、浓硫酸敞口放置,溶液质量增加 C、盛石灰水的试剂瓶壁产生一层白膜 D、滴有酸酞的氢氧化钠溶液中加入木炭后红色消失10. 两瓶标签损毁的溶液分别是稀盐酸、稀硫酸,下列试剂中能够用来区分两种溶液的是. ( )A、锌粒 B、氯化钡溶液 C、紫色石蕊溶液 D、氢氧化钠溶液二、填空题
-
11. 从氢、碳、氧、钙四种元素中选择适当的元素组成下列物质,写出它们的化学式:(1)、酸;(2)、碱;(3)、盐;(4)、氧化物12. 硫酸和盐酸是两种重要的化工原料。(1)、浓硫酸常用作干燥剂因为它具有 , 浓盐酸因为有而要密封保存。(2)、写出稀硫酸与下类物质反应的化学方程式。
①和镁条的反应:。
②和碳酸钠溶液反应:。
③和氯化钡溶液反应:。
上述反应中属于复分解反应的有;属于酸的共同性质的有 (填编号);不同的酸性质差异的原因。
(3)、盐酸的下列用途中,不能用硫酸代替盐酸的是。(填编号)①金属表面除锈 ②制造药物氯化锌 ③除去氯化钠中的少量碳酸钠
(4)、某实验小组探究酸的化学性质,在做盐酸除铁锈的试验时发现:铁锈的主要成分是 , 为除去铁钉上的锈迹,某学生将带锈迹的铁钉放入过量的盐酸中,他首先看到锈迹溶解,溶液呈色。这是因为(用化学方程式表示);不一会儿,又看到溶液中有的现象,这是因为铁钉部分溶解(用化学方程式表示)。13. 研究物质的溶解对于生产、生活有着重要意义。①下表是硝酸钾的部分溶解度数据。
温度(℃)
20
40
60
80
溶解度(g/100g水)
31.6
63.9
110
169
由表中数据可知,硝酸钾的溶解度随温度升高而 (选填“变大”或“变小”)。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为 , 能将该饱和溶液转化为不饱和溶液的一种方法是。
②探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。向硝酸钾中分批加水,充分搅拌,现象如图所示

坐标图中,符合实验结果的描点可能是(选填编号)。
③取等质量甲和乙两种物质(均不含结晶水)进行如图所示实验,最终烧杯中析出固体的质量乙大于甲。
40℃时,甲的溶解度(选填“大于”“等于”或“小于”)乙的溶解度。根据本实验结果,能否判断40∼80℃间甲、乙哪种物质的溶解度变化随温度影响更大(选填“能”或“不能”)。三、简答题
-
14. 下图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:
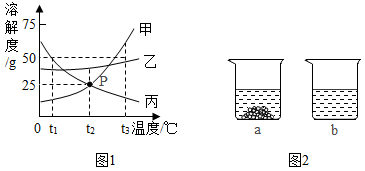 (1)、t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是。(2)、P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为。(3)、t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,则烧杯a中溶解的物质是(填“甲”或‘‘乙”),所得溶液的质量为g。(4)、当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用(填(“降温”或“蒸发”)结晶的方法提纯甲物质。(5)、下列说法正确的是(填字母序号)。
(1)、t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是。(2)、P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为。(3)、t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,则烧杯a中溶解的物质是(填“甲”或‘‘乙”),所得溶液的质量为g。(4)、当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用(填(“降温”或“蒸发”)结晶的方法提纯甲物质。(5)、下列说法正确的是(填字母序号)。A 将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
B 将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质最分数增大
C 将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙
D 将t3℃三种物质的饱和溶液降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
四、实验题
-
15. 某同学配制50g 6%的氯化钠溶液,整个操作过程中如下图所示,回答下列问题:
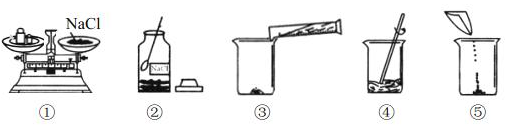 (1)、配制溶液的正确操作顺序为(填序号,下同),其中操作错误的是。(2)、图②中盛放氯化钠固体的仪器名称是 , 需称取氯化钠g。(3)、量水时选用的量筒的量程最合适的是(填序号),读数时视线要与量筒内保持水平。
(1)、配制溶液的正确操作顺序为(填序号,下同),其中操作错误的是。(2)、图②中盛放氯化钠固体的仪器名称是 , 需称取氯化钠g。(3)、量水时选用的量筒的量程最合适的是(填序号),读数时视线要与量筒内保持水平。A.10mL B.25mL C.50mL D.100mL
(4)、取上述溶液10g加水g,可稀释得到3%的NaCl溶液。(5)、若该同学配制的溶液溶质质量分数偏小,可能的原因是____________(填序号)。A、氯化钠固体不纯 B、用生锈砝码称量 C、装瓶时有少量溶液洒出 D、溶解前烧杯内有少量水五、计算题
-
16. 某化学兴趣小组的同学采集了一些大理石样品,为测定该样品中碳酸钙的质量分数,取样品6g粉碎成粉末状置于烧杯中,向其中加入10%的稀盐酸并不断搅拌,恰好不再有气泡产生时(已知杂质不与稀盐酸反应),共用去稀盐酸36.5g.(反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2á)(1)、用质量分数为36%的浓盐酸100g配制成所需10%的稀盐酸,需加入水的质量为g.(2)、计算样品中碳酸钙的质量分数.(结果保留到0.1%)
-
-