浙江省台州市椒江二中2020-2021学年九年级上学期科学期中考试试卷(到第3章第3节)
试卷更新日期:2020-11-25 类型:期中考试
一、选择题(4分一题)
-
1. 下列实验结论正确的是( )A、向某无色溶液中滴加酚酞试液变红,则溶液一定是碱溶液 B、向某固体中滴加稀盐酸,有气泡产生,该固体一定是碳酸盐 C、含碳元素的物质充分燃烧生成CO2,则燃烧能生成CO2的物质一定含碳元素 D、向某溶液中加入BaCl2溶液和稀硝酸,出现白色沉淀,则该溶液一定含有SO42−2. 用弹簧测力计沿水平方向两次拉着同一物体在同一水平面上运动,两次运动的s−t图象如图所示,其对应的弹簧测力计示数分别为F1 , F2 , 相同时间内所做的功分别为W 1 ,W2 , 则它们的关系正确的是( )
 A、F1=F2 W1>W2 B、F1>F2 W1>W2 C、F1=F2 W1<W2 D、F1<F2 W1<W23. 在加压降温的条件下,不具酸性的氯气液化为油状液体叫液氯。氯气溶于水得到的水溶液叫氯水,其中含有H+、Cl-等离子。下列说法错误的是( )A、氯气溶于水时发生了化学变化 B、液氯与氯水一样都具有酸性 C、往氯水中滴加碳酸钠溶液会有气泡生成 D、往氯水中滴加硝酸银溶液后有白色沉淀产生4. 下列叙述不符合实验事实的是( )A、将CO2气体通入CaCl2溶液中,没有白色沉淀产生 B、向滴有酚酞试液的蒸馏水中加入Fe(OH)3 , 溶液显红色 C、在Na2CO3、K2SO4、AgNO3溶液中分别滴加BaCl2溶液,都有白色沉淀生成 D、久置于空气中的熟石灰,加入稀盐酸会有气体放出5. 如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1 , 再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2 , 下列说法正确的是( )
A、F1=F2 W1>W2 B、F1>F2 W1>W2 C、F1=F2 W1<W2 D、F1<F2 W1<W23. 在加压降温的条件下,不具酸性的氯气液化为油状液体叫液氯。氯气溶于水得到的水溶液叫氯水,其中含有H+、Cl-等离子。下列说法错误的是( )A、氯气溶于水时发生了化学变化 B、液氯与氯水一样都具有酸性 C、往氯水中滴加碳酸钠溶液会有气泡生成 D、往氯水中滴加硝酸银溶液后有白色沉淀产生4. 下列叙述不符合实验事实的是( )A、将CO2气体通入CaCl2溶液中,没有白色沉淀产生 B、向滴有酚酞试液的蒸馏水中加入Fe(OH)3 , 溶液显红色 C、在Na2CO3、K2SO4、AgNO3溶液中分别滴加BaCl2溶液,都有白色沉淀生成 D、久置于空气中的熟石灰,加入稀盐酸会有气体放出5. 如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1 , 再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2 , 下列说法正确的是( )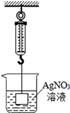 A、F2<F1 B、F2>F1 C、F2=F1 D、无法判断6. 现有四种白色固体:①氯化钠 ②氯化钡 ③无水硫酸铜 ④硫酸钠,不使用其它试剂(可以用水)就可以把它们区分开,区分出的先后顺序是( )A、②③④① B、②④③① C、③①④② D、③②④①7. 初中科学实验中,有许多涉及操作上的“先”与“后”的问题,如果把“先”与“后”顺序颠倒,就会影响实验效果或导致事故的发生。下列描述的实验操作中“先”“后”顺序正确的是( )A、使用显微镜观察细胞时,先调节细准焦螺旋,后调节粗准焦螺旋 B、稀释浓硫酸时,先将浓硫酸倒入烧杯中,后将水沿着烧杯壁慢慢倒入浓硫酸中 C、实验室制取氧气,停止加热时,应先熄灭酒精灯,再把导管移出水面 D、用氢气还原氧化铜时,应先通氢气一会儿,后点燃酒精灯加热8. 如图是一款变色眼镜,它的镜片内含有溴化银和氧化铜。在强光照射下,溴化银分解成单质溴和银,镜片颜色变深;当光线变暗时,溴和银在氧化铜催化作用下,又立即化合成溴化银,镜片颜色变浅。有关该眼镜的说法错误的是( )
A、F2<F1 B、F2>F1 C、F2=F1 D、无法判断6. 现有四种白色固体:①氯化钠 ②氯化钡 ③无水硫酸铜 ④硫酸钠,不使用其它试剂(可以用水)就可以把它们区分开,区分出的先后顺序是( )A、②③④① B、②④③① C、③①④② D、③②④①7. 初中科学实验中,有许多涉及操作上的“先”与“后”的问题,如果把“先”与“后”顺序颠倒,就会影响实验效果或导致事故的发生。下列描述的实验操作中“先”“后”顺序正确的是( )A、使用显微镜观察细胞时,先调节细准焦螺旋,后调节粗准焦螺旋 B、稀释浓硫酸时,先将浓硫酸倒入烧杯中,后将水沿着烧杯壁慢慢倒入浓硫酸中 C、实验室制取氧气,停止加热时,应先熄灭酒精灯,再把导管移出水面 D、用氢气还原氧化铜时,应先通氢气一会儿,后点燃酒精灯加热8. 如图是一款变色眼镜,它的镜片内含有溴化银和氧化铜。在强光照射下,溴化银分解成单质溴和银,镜片颜色变深;当光线变暗时,溴和银在氧化铜催化作用下,又立即化合成溴化银,镜片颜色变浅。有关该眼镜的说法错误的是( ) A、塑料是有机合成材料 B、铜螺丝久置在潮湿的空气中会产生铜锈 C、溴化银分解后,银元素的化合价升高 D、溴和银化合成溴化银前后,氧化铜化学性质不变9. 科学家发现一种新金属。根据图表信息推测其用途错误的是( )
A、塑料是有机合成材料 B、铜螺丝久置在潮湿的空气中会产生铜锈 C、溴化银分解后,银元素的化合价升高 D、溴和银化合成溴化银前后,氧化铜化学性质不变9. 科学家发现一种新金属。根据图表信息推测其用途错误的是( )熔点
2500℃
密度
3g/cm3
强度
与钢相似
导电性
良好
导热性
良好
抗腐蚀性
优异
A、用于焊接金属 B、制造航天飞机 C、制外科手术刀 D、用于通讯设备10. 氢氧化钴[Co(OH)2]能与酸性溶液反应,可作涂料和清漆的干燥剂。制备方法为:①Co+2HCl═CoCl2+H2↑;②CoCl2+2NaOH═Co(OH)2↓+2NaCl下列判断正确的是( )
A、①为复分解反应 B、钴的金属活动性比铜弱 C、氢氧化钴可以干燥氯化氢气体 D、氢氧化钴是一种难溶性碱11. 如图所示,用力将质量相同的甲、乙两物分别沿斜面AB、DC推至平台B上.将甲物体推上平台做的功W甲比将乙物体推上平台做的功W乙多,下列说法中正确的是( ) A、甲物体的重力势能大 B、乙物体的重力势能大 C、两个物体的重力势能一样大 D、无法判断哪个物体的重力势能大12. 在氢氧化钠溶液中加入一定量的稀硫酸后,下列实验能证明两者恰好完全中和的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、测得反应后溶液中Na+与SO42−个数比为2:1 D、滴入适量BaCl2溶液和稀硝酸,观察到有白色沉淀13. 小丽为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了以下方案的进行检验,放入以下溶液中,根据实验现象判断正确的是( )A、盐酸,有气泡生成,为铝 B、氯化铝溶液,有白色金属生成,为铁 C、硝酸锌溶液,有金属生成,为铝 D、硫酸铜溶液,有白色金属生成,为铁14. 将20克10%的盐酸与20克10%的氢氧化钠溶液混合,下列物质中能跟该混合溶液发生反应的是( )A、氯化钡 B、氯化铁 C、二氧化碳 D、氢氧化钾15.
A、甲物体的重力势能大 B、乙物体的重力势能大 C、两个物体的重力势能一样大 D、无法判断哪个物体的重力势能大12. 在氢氧化钠溶液中加入一定量的稀硫酸后,下列实验能证明两者恰好完全中和的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、测得反应后溶液中Na+与SO42−个数比为2:1 D、滴入适量BaCl2溶液和稀硝酸,观察到有白色沉淀13. 小丽为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了以下方案的进行检验,放入以下溶液中,根据实验现象判断正确的是( )A、盐酸,有气泡生成,为铝 B、氯化铝溶液,有白色金属生成,为铁 C、硝酸锌溶液,有金属生成,为铝 D、硫酸铜溶液,有白色金属生成,为铁14. 将20克10%的盐酸与20克10%的氢氧化钠溶液混合,下列物质中能跟该混合溶液发生反应的是( )A、氯化钡 B、氯化铁 C、二氧化碳 D、氢氧化钾15.如图所示,铅球从出手到将要落地的过程中,下列说法正确的是(不计空气阻力)( )
 A、铅球由a→b时,动能逐渐增大 B、铅球在b点的机械能大于a点的机械能 C、铅球由b→c时,机械能逐渐减小 D、铅球在c点时动能最大
A、铅球由a→b时,动能逐渐增大 B、铅球在b点的机械能大于a点的机械能 C、铅球由b→c时,机械能逐渐减小 D、铅球在c点时动能最大二、填空题
-
16. 某工人在水平地面上用150N的水平推力推动重为800N的物体匀速直线前行了4m,松手后物体向前滑行1m。则在整个过程中,重力做的功为J,摩擦力做的功为J,推力做的功为J。17. 室温时,向滴加了无色酚酞的Ba(OH)2溶液的烧杯中逐滴加入稀硫酸,烧杯内溶液中的溶质质量变化如图所示:
 (1)、c点溶液中的溶质为。(2)、ob段实验的现象是。18. 由一种盐和一种碱组成的固体混合物,按如图的步骤进行实验.请回答:
(1)、c点溶液中的溶质为。(2)、ob段实验的现象是。18. 由一种盐和一种碱组成的固体混合物,按如图的步骤进行实验.请回答:
 (1)、原固体混合物中的碱可能是 .(2)、写出步骤①、③中反应的化学方程式:①;③ .19. 某化工厂流程会产生澄清废水,其中可能含有的离子是Ag+、Cu2+、Cl−、NO3− , 已知:白色的沉淀Fe(OH)2在空气中会迅速转化为红褐色的Fe(OH)3.
(1)、原固体混合物中的碱可能是 .(2)、写出步骤①、③中反应的化学方程式:①;③ .19. 某化工厂流程会产生澄清废水,其中可能含有的离子是Ag+、Cu2+、Cl−、NO3− , 已知:白色的沉淀Fe(OH)2在空气中会迅速转化为红褐色的Fe(OH)3.①取少量废水,加入过量稀盐酸,产生白色沉淀;再加入过量氢氧化钠溶液,产生蓝色沉淀。该废水中含有的金属离子是.
②兴趣小组设计了一个除去该废水中原有金属离子的实验方案,部分流程如图所示。操作I的名称是 , 单质A是.
 20. 从Na2CO3、NaOH、HCl、BaCl2、NaCl几种溶液中取出其中的两种混合,回答下列问题:(1)、能够发生反应的组合有种。(2)、若混合后溶液质量减少,发生的反应方程式为:、.(3)、向HCl和BaCl2和混合溶液中滴加Na2CO3 , 请在图中坐标中画出沉淀质量与加入Na2CO3溶液质量的关系图。
20. 从Na2CO3、NaOH、HCl、BaCl2、NaCl几种溶液中取出其中的两种混合,回答下列问题:(1)、能够发生反应的组合有种。(2)、若混合后溶液质量减少,发生的反应方程式为:、.(3)、向HCl和BaCl2和混合溶液中滴加Na2CO3 , 请在图中坐标中画出沉淀质量与加入Na2CO3溶液质量的关系图。 21. 图甲所示的铁块重力G=4N,被吸附在竖直放置且足够长的磁性平板上,当它在竖直方向上拉力F=6N的作用下向上运动时,铁块受到的摩擦力为N;铁块此时速度v与时间t的关系图象如图乙所示,则4s内拉力F做功是J。
21. 图甲所示的铁块重力G=4N,被吸附在竖直放置且足够长的磁性平板上,当它在竖直方向上拉力F=6N的作用下向上运动时,铁块受到的摩擦力为N;铁块此时速度v与时间t的关系图象如图乙所示,则4s内拉力F做功是J。
三、实验探究题
-
22. 实验表明浓硫酸与焦炭在加热的条件下能发生反应.经查阅资料得知:
①SO2可使澄清石灰水变浑浊;
②SO2可使品红溶液的红色褪去,而CO2不能;
③SO2可与酸性的KMnO4溶液反应使其褪色,而CO2不能;
④CuSO4为白色粉末,遇水可生成胆矾.
⑤浓硫酸与焦炭在加热的条件下发生如下反应:C+2H2SO4(浓) △= CO2↑+2SO2↑+2H2O
在对该反应的产物的探究中需用下列A、B、C装置:

请根据提供的信息回答下列问题:
(1)、装置B中的品红I的作用是(2)、若按BAC的顺序组装,不能证明产物;(3)、若要证明这三种产物,正确的组装顺序是.23. 以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐.(1)、加水溶解后,用如图装置除去粗盐中的泥沙,玻璃棒的作用是 . (2)、为除去Na2SO4、MgCl2、CaCl2 , 并得到中性的实验溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液,能达到目的顺序是A、⑤③②①④ B、③⑤①④② C、③⑤①②④(3)、用pH试纸检验溶液是否呈中性的操作是 .24. 在研究“物体动能与质量和速度的关系”实验中,将钢球从某一高度由静止释放,钢球摆到竖直位置时,撞击水平木板上的木块,将木块撞出一段距离。
(2)、为除去Na2SO4、MgCl2、CaCl2 , 并得到中性的实验溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液,能达到目的顺序是A、⑤③②①④ B、③⑤①④② C、③⑤①②④(3)、用pH试纸检验溶液是否呈中性的操作是 .24. 在研究“物体动能与质量和速度的关系”实验中,将钢球从某一高度由静止释放,钢球摆到竖直位置时,撞击水平木板上的木块,将木块撞出一段距离。 (1)、本实验使钢球获得动能的操作方法是 。(2)、第1次实验时若不考虑能量损失,钢球对木块最多可做J的功;第3次实验时,木块被撞后滑出木板无法记录数据,需要重做第三次实验,甲同学建议换用同样较长的木板,乙同学建议换一个较大的木块,丙同学建议降低钢球下摆的高度,你认为应当采用同学的建议。(g取10N/kg)(3)、由上述实验数据和现象可得出结论:。25. 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。
(1)、本实验使钢球获得动能的操作方法是 。(2)、第1次实验时若不考虑能量损失,钢球对木块最多可做J的功;第3次实验时,木块被撞后滑出木板无法记录数据,需要重做第三次实验,甲同学建议换用同样较长的木板,乙同学建议换一个较大的木块,丙同学建议降低钢球下摆的高度,你认为应当采用同学的建议。(g取10N/kg)(3)、由上述实验数据和现象可得出结论:。25. 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。【进行猜想】

猜想Ⅰ:该溶液的溶质是NaCl;猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;猜想 IV:该溶液的溶质是NaHCO3。
(1)、【查阅资料】常温下物质的相关信息如表:物质
NaCl
NaOH
Na2CO3
NaHCO3
常温下的溶解度/g
36
109
21.5
9.6
常温下稀溶液的pH
7
13
11
9
从物质的相关信息可知,该溶液的溶质不是NaHCO3 , 因为常温下NaHCO3溶液溶质的质量分数最大是(精确到0.1%)。
(2)、【进行实验】测定溶液的pH大于7,该溶液的溶质不是(填化学式)。(3)、同学们又进行了如下实验,实验过程如图:
①产生白色沉淀的化学方程式是。
②实验可以判断原无色溶液中含有的溶质有。
(4)、【获得结论】该瓶原来装的无色溶液的溶质是NaOH,并且(填“没有”、“部分”或“全部”)变质。四、解答题(26题8分,27题9分,28题8分,29题12分,30题8分,31题10分,共55分)
-
26. 含硫的物质在实验室或工业生产过程中可出现下列图示的转化:
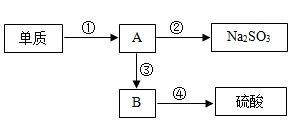 (1)、实验室中,点燃少量单质硫于充满氧气的集气瓶中燃烧,产生漂亮的蓝紫色火焰,生成物质A.A是工业排放物中一种主要的空气污染物,也是酸雨形成的主因之一.根据你学过的知识可将A转化成Na2SO3 , 你提供的试剂是 .(2)、在硫酸工业中,将A在一定条件下与空气中的物质反应得到B,B与水结合得到硫酸.B与A的组成元素相同,B中硫元素与硫酸中硫元素化合价相同,写出A转化成B的化学方程式: .(3)、上述物质转化过程中,属于化合反应的是(填序号).(4)、若回收工业排放物A 32吨,理论上可生产硫酸 吨.27. 如图是一种投入使用的新型安全校车,中考期间,某中学的学生乘坐这种新型安全校车到18km外的考点参加考试,校车行驶了30min后安全到达考点,
(1)、实验室中,点燃少量单质硫于充满氧气的集气瓶中燃烧,产生漂亮的蓝紫色火焰,生成物质A.A是工业排放物中一种主要的空气污染物,也是酸雨形成的主因之一.根据你学过的知识可将A转化成Na2SO3 , 你提供的试剂是 .(2)、在硫酸工业中,将A在一定条件下与空气中的物质反应得到B,B与水结合得到硫酸.B与A的组成元素相同,B中硫元素与硫酸中硫元素化合价相同,写出A转化成B的化学方程式: .(3)、上述物质转化过程中,属于化合反应的是(填序号).(4)、若回收工业排放物A 32吨,理论上可生产硫酸 吨.27. 如图是一种投入使用的新型安全校车,中考期间,某中学的学生乘坐这种新型安全校车到18km外的考点参加考试,校车行驶了30min后安全到达考点, (1)、求校车在送考过程中的平均速度。(2)、若校车和学生的总质量为9000kg,车轮与地面接触的总面积为0.2m2.求校车对水平路面的压强(g取10N/kg)(3)、若校车以54Km/h的速度在一段平直路面上匀速行驶,校车受到的牵引力为5000N.求校车发动机牵引力的功率。28. 实验小组在实验室找到一瓶含有铜和镁的均匀混合物。为测定该混合物中镁的质量分数,分别取一定质量的混合物与稀硫酸进行反应,实验分四组,所得数据如下表所示:请分析数据,回答下列问题:
(1)、求校车在送考过程中的平均速度。(2)、若校车和学生的总质量为9000kg,车轮与地面接触的总面积为0.2m2.求校车对水平路面的压强(g取10N/kg)(3)、若校车以54Km/h的速度在一段平直路面上匀速行驶,校车受到的牵引力为5000N.求校车发动机牵引力的功率。28. 实验小组在实验室找到一瓶含有铜和镁的均匀混合物。为测定该混合物中镁的质量分数,分别取一定质量的混合物与稀硫酸进行反应,实验分四组,所得数据如下表所示:请分析数据,回答下列问题:实验组
第1组
第2组
第3组
第4组
取用金属混合物的质量/g
10
10
20
20
取用稀硫酸的质量/g
100
120
100
120
反应后过滤、洗涤、干燥后的固体质量/g
8
8
17
m
(1)、该混合物中镁的质量分数为多少?(2)、表中的 m=(填数值)。(3)、计算第 3 组实验中所得溶液溶质的质量分数。(写出计算过程,结果精确到 0.1%)29. 我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题: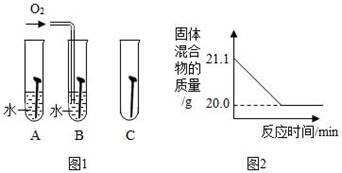 (1)、I.铁制品广泛应用于生产、生活中。
(1)、I.铁制品广泛应用于生产、生活中。①下列不属于铁合金的是(选填字母)。
A.Fe(OH)3 B. 生铁 C. 不锈钢
②图1是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是(选填字母)。
(2)、II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。在Fe2O3中,氧元素的质量分数为 。
(3)、赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2Fe2O3+C 4FeO+CO2↑.现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图2为固体混合物的质量随反应时间的变化曲线。①由图可知:生成CO2气体的质量为 g。
②计算反应后固体混合物中FeO的质量分数 (请根据化学方程式写出完整的计算步骤)
30. 听说墨鱼骨能治疗胃酸过多,好学的小科和小妍想探个究竟。查阅资料,墨鱼骨含碳酸钙80%∼85%以上,还含有多种氨基酸。 (1)、墨鱼骨能治疗胃酸过多的原因是:(用化学方程式表示).(2)、为了测定墨鱼骨中碳酸钙的含量,他们先将墨鱼骨洗净晒干,并按各自设计实验方法进行研究。
(1)、墨鱼骨能治疗胃酸过多的原因是:(用化学方程式表示).(2)、为了测定墨鱼骨中碳酸钙的含量,他们先将墨鱼骨洗净晒干,并按各自设计实验方法进行研究。
小科称取10克洗净晒干的墨鱼骨,高温灼烧至质量不变,冷却后称得剩余固体质量为5.4克。处理如下:CO2质量=10克−5.4克=4.6克
设碳酸钙质量为M
CaCO3
CO2↑+CaO
100
44
M
4.6克
所以M=10.5克
CaCO3%=10.5克10克×100%=105%
小科的计算结果与事实不符,产生错误的原因是:.
(3)、小研用如图所示的实验装置进行实验,其中浓硫酸的作用是.(4)、小妍将30mL稀盐酸分3次加入到3克样品中,每次加入盐酸后充分反应,待量筒内的水的体积不再变化时,读出水的体积,结果见下表。已知本实验条件下CO2的密度为2.0克/升,求:该墨鱼骨粉样品中CaCO3的质量分数。第一次
第二次
第三次
加入稀盐酸的体积(毫升)
10
10
10
进入量筒内水的体积(毫升)
220
220
110
31. 玻璃是由炽热的玻璃液体冷却后形成的。受油滴能在水面均匀分布开来的启发,科研人员发明了一种制取平板玻璃的方法。其主要过程是让玻璃液体浮于某溶液表面上,冷凝后用真空吸盘吊运,如下图所示。 (1)、该方法的关键是能否找到会浮起玻璃液体的一种溶液,你认为这种溶液应具备怎样的物理特征?(说出两点)(2)、一块密度为2.5×103kg/m3 , 体积为1.5×10−2m3的平板玻璃,冷凝后用真空吸盘吊运转送,若当时大气压为1×105Pa,则吸盘的面积至少是多少m2?(3)、将上述玻璃板提升1m,需克服重力做多少功?
(1)、该方法的关键是能否找到会浮起玻璃液体的一种溶液,你认为这种溶液应具备怎样的物理特征?(说出两点)(2)、一块密度为2.5×103kg/m3 , 体积为1.5×10−2m3的平板玻璃,冷凝后用真空吸盘吊运转送,若当时大气压为1×105Pa,则吸盘的面积至少是多少m2?(3)、将上述玻璃板提升1m,需克服重力做多少功?