山东省威海乳山市2019-2020学年九年级上学期化学期末考试试卷
试卷更新日期:2020-11-16 类型:期末考试
一、单选题
-
1. 下列有关水和溶液的说法正确的是( )A、溶液是一种均一、稳定的混合物,溶液中各部分的性质相同 B、饱和溶液析出晶体后,溶液的溶质质量分数一定减少 C、通过洗洁精的乳化作用,可将食用油溶解于水形成溶液 D、试剂瓶中的溶液在使用时不慎酒出一部分,剩余溶液的溶质质量分数减少2. 现有质量分数为10%的某溶液,若使其质量分数增大一倍,可采用方法是( )A、将溶剂蒸发掉一半 B、将溶质质量增大一倍 C、蒸发溶剂的质量为原溶液质量的1/2 D、溶质、溶剂质量同时减少3. 如图为硫酸性质的知识归纳,下列表达错误的是( )
 A、若盐为BaCl2的溶液,则反应中有白色沉淀生成 B、若碱为NaOH的溶液,可以在溶液中滴加酚酞溶液,证明两者发生了中和反应 C、若金属氧化物为铁锈的主要成分(Fe2O3),可以利用硫酸与金属氧化物反应的这一性质,除去铁锈 D、若金属为Mg和Zn,将质量相等且过量的两种金属与一定量的稀硫酸完全反应,Mg产生的H2多4. 婷婷周一的早餐是:油条、豆浆和豆腐乳。分析她的早餐中缺少的营养成分是( )A、糖类 B、蛋白质 C、油脂 D、维生素5. 下图是用海水提取粗盐的大致过程。下列说法错误的是( )
A、若盐为BaCl2的溶液,则反应中有白色沉淀生成 B、若碱为NaOH的溶液,可以在溶液中滴加酚酞溶液,证明两者发生了中和反应 C、若金属氧化物为铁锈的主要成分(Fe2O3),可以利用硫酸与金属氧化物反应的这一性质,除去铁锈 D、若金属为Mg和Zn,将质量相等且过量的两种金属与一定量的稀硫酸完全反应,Mg产生的H2多4. 婷婷周一的早餐是:油条、豆浆和豆腐乳。分析她的早餐中缺少的营养成分是( )A、糖类 B、蛋白质 C、油脂 D、维生素5. 下图是用海水提取粗盐的大致过程。下列说法错误的是( ) A、海水进入贮水池,海水的成分基本不变 B、析出晶体后的母液是氯化钠的不饱和溶液 C、在蒸发池中,海水中水的质量逐渐减少 D、在蒸发池中,海水中氯化钠的质量分数逐渐增大6. 分析推理是化学学习中常用的思维方法。下列说法正确的是( )A、酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定呈酸性 B、溶液具有均一、稳定的特征,所以均一、稳定的物质一定是溶液 C、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 D、复分解反应中有沉淀、气体或水生成,所以有上述物质生成的反应就是复分解反应7. 归纳整理是一种很好的学习方法。下面是同学们在复习中梳理得到的一组图像,其中图像与实验表述一致的是( )A、
A、海水进入贮水池,海水的成分基本不变 B、析出晶体后的母液是氯化钠的不饱和溶液 C、在蒸发池中,海水中水的质量逐渐减少 D、在蒸发池中,海水中氯化钠的质量分数逐渐增大6. 分析推理是化学学习中常用的思维方法。下列说法正确的是( )A、酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定呈酸性 B、溶液具有均一、稳定的特征,所以均一、稳定的物质一定是溶液 C、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 D、复分解反应中有沉淀、气体或水生成,所以有上述物质生成的反应就是复分解反应7. 归纳整理是一种很好的学习方法。下面是同学们在复习中梳理得到的一组图像,其中图像与实验表述一致的是( )A、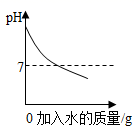 加水稀释NaOH溶液
B、
加水稀释NaOH溶液
B、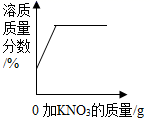 一定温度下,向不饱和KNO3溶液中加入KNO3固体
C、
一定温度下,向不饱和KNO3溶液中加入KNO3固体
C、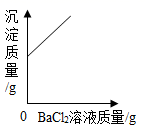 向一定量的稀硫酸中滴加BaCl2溶液,
D、
向一定量的稀硫酸中滴加BaCl2溶液,
D、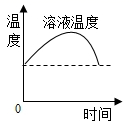 硝酸铵溶于水后温度的变化
8. 生活中处处充满化学。下列生活中的化学知识叙述正确的是( )A、用纯碱溶液除去水壶中的水垢 B、常用钢丝球擦洗铝壶可以使其光亮洁净和更耐用 C、波尔多液不能用铁桶盛放 D、洗涤剂常用来洗涤油污,是因为洗涤剂能溶解油污9. 下列各组溶液中,不用其它试剂就不能鉴别出来的是( )A、FeCl3 NaOH HCl KCl B、BaCl2 Na2SO4 Na2CO3 HCl C、CuSO4 NaOH KNO3 BaCl2 D、KCl AgNO3 HCl HNO310. 除去下列物质中的少量杂质,所选用的试剂和操作方法不可行的是( )
硝酸铵溶于水后温度的变化
8. 生活中处处充满化学。下列生活中的化学知识叙述正确的是( )A、用纯碱溶液除去水壶中的水垢 B、常用钢丝球擦洗铝壶可以使其光亮洁净和更耐用 C、波尔多液不能用铁桶盛放 D、洗涤剂常用来洗涤油污,是因为洗涤剂能溶解油污9. 下列各组溶液中,不用其它试剂就不能鉴别出来的是( )A、FeCl3 NaOH HCl KCl B、BaCl2 Na2SO4 Na2CO3 HCl C、CuSO4 NaOH KNO3 BaCl2 D、KCl AgNO3 HCl HNO310. 除去下列物质中的少量杂质,所选用的试剂和操作方法不可行的是( )序号
物质
杂质
除杂选用的物质和操作方法
A
O2
水蒸气
通过盛有生石灰的干燥管
B
Na2CO3粉末
NaHCO3
加热
C
KNO3固体
NaCl固体
溶解、蒸发结晶
D
CuSO4溶液
硫酸
加入过量的CuO粉末,充分反应后过滤
A、A B、B C、C D、D11. 下列离子在pH=11的溶液中能大量共存的是( )A、Cu2+ SO42- Cl- Na B、Mg2+ SO42- Na+ NO3- C、OH- K+ NO3- Ba2+ D、Na+ CO32- Ca2+ Cl-12. 下图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述一定正确的是( ) A、甲的溶解度一定大于乙的溶解度 B、20℃时甲、乙两物质的溶解度相等 C、30℃时甲的饱和溶液的溶质质量分数为60% D、降低温度可使接近饱和的甲溶液变成饱和溶液13. 下列关于Ba(OH)2性质的描述中,不属于碱的共同性质的是( )A、能使紫色石蕊溶液变蓝色 B、能与盐酸反应生成水 C、能与Na2SO4溶液反应生成BaSO4沉淀 D、能与MgCl2反应生成沉淀14. 取10g碳酸钙与溶质质量分数为10%的稀盐酸反应,恰好完全反应时得到溶液的质量为ag;另取10g碳酸钙高温完全分解,取生成的CaO与上述同浓度的稀盐酸反应,恰好完全反应时得到溶液的质量为bg,则a与b的大小关系为( )A、a=b B、a>b C、a<b D、不能确定15. 某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
A、甲的溶解度一定大于乙的溶解度 B、20℃时甲、乙两物质的溶解度相等 C、30℃时甲的饱和溶液的溶质质量分数为60% D、降低温度可使接近饱和的甲溶液变成饱和溶液13. 下列关于Ba(OH)2性质的描述中,不属于碱的共同性质的是( )A、能使紫色石蕊溶液变蓝色 B、能与盐酸反应生成水 C、能与Na2SO4溶液反应生成BaSO4沉淀 D、能与MgCl2反应生成沉淀14. 取10g碳酸钙与溶质质量分数为10%的稀盐酸反应,恰好完全反应时得到溶液的质量为ag;另取10g碳酸钙高温完全分解,取生成的CaO与上述同浓度的稀盐酸反应,恰好完全反应时得到溶液的质量为bg,则a与b的大小关系为( )A、a=b B、a>b C、a<b D、不能确定15. 某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( ) A、HCl和H2SO4一定存在 B、NaOH、H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
A、HCl和H2SO4一定存在 B、NaOH、H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在二、填空题
-
16. 夏季,香甜可口、营养丰富的西瓜是人们喜爱的水果之一,下表列出的是每100g某品种西瓜可食用部分的主要营养成分数据。
营养成分
水分
蛋白质
脂肪
糖类
X
钙、磷、铁、锌
质量
92.5g
0.7g
0.2g
6.1g
6.8mg
17.1mg
(1)、表中“X”是一种人体必须的营养素,它是,其对人体的主要作用是。营养成分中含的(填元素符号) , 属于人体必需的微量元素。(2)、有人说,食用西瓜不能为人体补充能量。据西瓜的成分分析该说法是否正确,为什么?。17. 水是一种重要的溶剂,生病住院时,通常将药物溶解在生理盐水中进行输液。(已知生理盐水是溶质质量分数为0.9%的氯化钠溶液)现需100g生理盐水,试计算:(1)、需要称取一定量的氯化钠溶解在mL的蒸馏水中进行配制(计算蒸馏水体积)(2)、如果此生理盐水用10%的氯化钠溶液加水稀释而得到,则需10%的溶液g:(3)、如图1是硝酸钾和氯化钠的溶解度曲线。
①图1中A点表示的含义是:
②20℃,向50g水中加入25gNaCl,得到溶液(填“饱和”或“不饱和”):若要增大该溶液中溶质的质量分数,其方法是。
③水在化学实验中具有重要作用。将光亮的铁丝固定在U型管左端的塞子上(如图2),几天后,观察到的实验现象为;从实验中可以得出铁生锈的条件是。
18. 如图是a、b、c三种金属在相同条件下与相同浓度的盐酸反应的图象,试回答: (1)、a、b、c三种金属的活泼性顺序是:(2)、已知b和c两金属的化合价相同,若b是铁,则c可能是(填序号)。
(1)、a、b、c三种金属的活泼性顺序是:(2)、已知b和c两金属的化合价相同,若b是铁,则c可能是(填序号)。A铝 B锌 C镁
(3)、写出b(铁)与盐酸反应所对应的的离子方程式。三、流程题
-
19. 海洋是巨大的资源宝库,人类正在运用各种方法开发、提取海洋资源。(1)、海水晒盐得粗盐,粗盐提纯的实验步骤为:溶解、过滤、蒸发结晶。三步操作中均用到的一种玻璃仪器是 , 蒸发操作中该仪器的作用是。(2)、从海水中得到金属镁。用苦卤制取金属镁的流程图如图所示:

①步骤1发生反应的化学方程式为。
②验证苦卤中MgCl2已完全转化为Mg(OH)2沉淀的方法是。
(3)、海水制碱,流程图如图所示:
①该厂最终得到的产品有(填物质名称)。
②流程中加入过量BaCl2溶液、NaOH溶液和Na2CO3溶液,除掉的离子依次是(填离子符号,注意顺序)。
③写出流程Ⅱ中发生反应的化学方程式。
四、实验题
-
20. 为了探究铁、铜、银三种金属的活动性顺序,某同学设计了如下图所示的两个装置,进行实验完成了探究活动,你能猜测到该同学所用的溶液分别是什么?(请填写溶液名称):
 (1)、a;b.(2)、写出装置B中发生的化学反应方程式:。
(1)、a;b.(2)、写出装置B中发生的化学反应方程式:。五、科普阅读题
-
21. 阅读下面短文,回答相关问题。
硫酸铜为白色或灰白色粉末,吸水性很强,吸水后反应生成蓝色的五水合硫酸铜[Cu(H2O)4]SO4·H2O或CuSO4·5H2O],其水溶液因水合铜离子的缘故而呈现出蓝色,故在实验室里无水硫酸铜常被用于检验水的存在。硫酸铜常见的形态为蓝色晶体,即五水合硫酸铜,俗称胆矾或蓝矾,它并不稳定,在加热的条件下,逐渐失去结晶水而变成硫酸铜粉末,给硫酸铜粉末继续加热至650℃高温,可分解为黑色氧化铜、二氧化硫及氧气 (如图为胆矾加热过程中固体质量与温度的关系)。
硫酸铜有广泛的应用,如:工业上可用于电镀、定氨催化剂,无水硫酸铜用作脱水剂和气体干燥剂;农业上可与熟石灰混合制农药波尔多液,用于杀菌剂;医疗上可用于检测贫血及作催吐剂。

硫酸铜可以通过不同种方法制得,比如,下面的方法便可以制取硫酸铜。

硫酸铜属于重金属盐,有毒,对于人和动物都可因误食一定量而导致死亡,所以用量必须严格控制,若误食,应立即大量食用牛奶、鸡蛋清等富含蛋白质食品,或者使用EDTA钙钠盐解毒。
(1)、硫酸铜溶液呈现为蓝色的原因是。(2)、无水硫酸铜检验水存在的颜色变化是。(3)、胆矾加热至650℃高温后,发生反应的化学方程式是。(4)、在制备硫酸铜流程中,过滤后的溶液是硫酸铜溶液(填“饱和”或“不饱和”)(5)、关于硫酸铜说法正确的是。A 五水合硫酸铜的相对分子质量是250
B 胆矾受热至102℃时失去了部分结晶水
C 无水硫酸铜可作气体干燥剂
D 硫酸铜的水溶液也称作为波尔多液
六、科学探究题
-
22. 在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组用以下装置进行研究:

(查阅资料)I . 碎瓷片能防爆沸,碱石灰能作干燥剂。II. 氢气的化学性质与一氧化碳相似。
III. 铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引。
(推断)
(1)、观察到D中黑色固体变红,则B中生成的气体是。(2)、探究B装置中剩余固体成分是什么?(初步探究)B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想与假设)
猜想一:剩余固体是Fe和Fe3O4 猜想二:剩余固体是。
(3)、(实验探究)实验操作
实验现象
结论
取样,加入(填试剂)
猜想一正确
(4)、(实验结论)铁与水蒸气反应的化学方程式为 , 该反应为(填基本反应类型)。(5)、(含量测定)取B装置中剩余黑色固体5g,与足量的CO反应后,所得固体质量为4.36 g,则原剩余黑色固体中Fe3O4的质量分数为。23. 如图所示的暖宝宝是一种防寒用品。小明想知道暖宝宝中的主要成分有哪些?暖宝宝发热的原因是什么?
小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
(1)、(提出猜想)该黑色粉末可能含有木炭粉、铁粉、氧化铜中的一种或几种。(初步验证)将磁铁靠近黑色粉末,部分被吸引。
(得出结论)该黑色粉末中一定含有 , 可能含有。
(2)、(查阅资料)木炭与稀硫酸不反应,氧化铜与稀硫酸反应能产生蓝色溶液。(进行实验)
实验编号
实验操作
实验现象
①
取少量黑色粉末于试管中,加足量稀硫酸
固体部分溶解,有气泡产生,溶液未变蓝色
②
取实验①的残渣灼烧,将内壁涂有澄清石灰水的小烧杯罩在上方
澄清石灰水变浑浊
由实验①可知,该黑色粉末中一定含有 , 一定不含。
写出实验①的化学反应方程式。
由实验②可知,该黑色粉末中一定含有。
(3)、小明思考:暖宝宝为什么会发热?(查阅资料)暖宝宝中除含有铁粉、木炭外,还含有食盐和水。
①暖宝宝贴在衣服上与空气接触后会发热的原因是。由此可见,人们可以利用化学反应放出的热量来造福人类,请你再举一例:。
②请你猜测暖宝宝中氯化钠的作用是。
七、计算题
-
24. 某兴趣小组用40g生锈铁钉与足量的一定溶质质量分数的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设铁钉中除表面含有氧化铁外,没有其他杂质)。计算所用稀硫酸的溶质质量分数(写出计算过程)。

-
-
-