山东省德州市陵城区2019-2020学年九年级上学期化学期末考试试卷
试卷更新日期:2020-11-16 类型:期末考试
一、单选题
-
1. 下列诗句只涉及物理变化的是( )A、炉火照天地,红星乱紫烟 B、夜来风雨声,花落知多少 C、春蚕到死丝方尽,蜡炬成灰泪始干 D、月落乌啼霜满天,江枫渔火对愁眠2. 物质性质决定用途,下列说法错误的是( )A、氮气的化学性质稳定,可用于食品保护气 B、干冰升华需吸收大量的热,可用于人工降雨 C、O2能支持燃烧,可用作燃料 D、石墨有优良的导电性,可用于干电池的电极3. 下图所示的实验操作正确的是()A、氧气验满
 B、给液体加热
B、给液体加热  C、过滤
C、过滤  D、读取液体体积
D、读取液体体积  4. 分类法是学习化学的重要方法,下列有关说法正确的是( )A、金刚石、水银、钢都是金属单质 B、干冰、水、四氧化三铁都是氧化物 C、空气、冰水混合物、石灰水都是混合物 D、氯酸钾、硝酸铵、石灰石都是化合物5. 下列物质的分子模型可用“
4. 分类法是学习化学的重要方法,下列有关说法正确的是( )A、金刚石、水银、钢都是金属单质 B、干冰、水、四氧化三铁都是氧化物 C、空气、冰水混合物、石灰水都是混合物 D、氯酸钾、硝酸铵、石灰石都是化合物5. 下列物质的分子模型可用“ ”表示的是( ) A、He B、Cl2 C、CO D、H2O6. 事物的宏观表象是由其微观性质决定的。下列事实及对这些事实的解释中,二者不相符的是( )A、成熟的菠萝会散发出浓浓的香味,说明分子在不断地运动 B、水沸腾时能掀开壶盖,说明分子的大小随温度升高而增大 C、湿衣服晾在太阳晒着的地方干得快,说明分子的运动速率与温度有关 D、电解水生成氢气和氧气,说明在化学变化中,分子可以分成原子,原子再重新组合成新分子7. 将“神舟七号”飞船送入太空的是“长征二号”F运载火箭,火箭工作中发生的反应为:C2H8N2+2R=3N2+4H2O+2CO2;其中R的化学式是( )A、N2O4 B、NO2 C、N2O D、NH38. 某矿石样本含有如右图所示的四种元素,该矿石中可能含有的物质是( )
”表示的是( ) A、He B、Cl2 C、CO D、H2O6. 事物的宏观表象是由其微观性质决定的。下列事实及对这些事实的解释中,二者不相符的是( )A、成熟的菠萝会散发出浓浓的香味,说明分子在不断地运动 B、水沸腾时能掀开壶盖,说明分子的大小随温度升高而增大 C、湿衣服晾在太阳晒着的地方干得快,说明分子的运动速率与温度有关 D、电解水生成氢气和氧气,说明在化学变化中,分子可以分成原子,原子再重新组合成新分子7. 将“神舟七号”飞船送入太空的是“长征二号”F运载火箭,火箭工作中发生的反应为:C2H8N2+2R=3N2+4H2O+2CO2;其中R的化学式是( )A、N2O4 B、NO2 C、N2O D、NH38. 某矿石样本含有如右图所示的四种元素,该矿石中可能含有的物质是( ) A、 B、 C、 D、9. 北京奥运会“祥云”火炬载着中国人民对世界人民的友谊,它采用的燃料是丙烷(分子结构模型如图),下列关于丙烷分子的说法错误的是( )
A、 B、 C、 D、9. 北京奥运会“祥云”火炬载着中国人民对世界人民的友谊,它采用的燃料是丙烷(分子结构模型如图),下列关于丙烷分子的说法错误的是( ) A、丙烷分子由碳元素和氢元素组成 B、丙烷分子中碳原子和氢原子的个数比为3:8 C、丙烷分子由碳原子和氢原子构成 D、一个丙烷分子中含有26个质子10. 学化学、用化学,下列说法错误的是( )A、点燃氢气前要先检验氢气的纯度 B、CO 有毒且无色无味,使用CO 作燃气时要注意室内通风 C、农药、化肥的不合理施用,会造成水体污染 D、醋酸除水垢利用的是物理变化11. 下列描述错误的是( )A、不同的碳单质物理性质差异大,是因为碳原子的排列方式不同 B、H2O2和H2O化学性质差异大,是因为构成物质的分子不同 C、氢元素和氧元素化学性质差异大,是因为其原子的最外层电子数不同 D、钠元素和镁元素种类不同,是因为中子数不同12.
A、丙烷分子由碳元素和氢元素组成 B、丙烷分子中碳原子和氢原子的个数比为3:8 C、丙烷分子由碳原子和氢原子构成 D、一个丙烷分子中含有26个质子10. 学化学、用化学,下列说法错误的是( )A、点燃氢气前要先检验氢气的纯度 B、CO 有毒且无色无味,使用CO 作燃气时要注意室内通风 C、农药、化肥的不合理施用,会造成水体污染 D、醋酸除水垢利用的是物理变化11. 下列描述错误的是( )A、不同的碳单质物理性质差异大,是因为碳原子的排列方式不同 B、H2O2和H2O化学性质差异大,是因为构成物质的分子不同 C、氢元素和氧元素化学性质差异大,是因为其原子的最外层电子数不同 D、钠元素和镁元素种类不同,是因为中子数不同12.小明根据如图所示的信息,明白了不能把一氧化碳(CO)化学式写成“Co”的原因。下列针对CO和Co的说法中,正确的是( )

①一个钴原子中有27个质子②Co表示非金属元素
③CO是由两种元素组成的化合物④CO和Co都含有碳元素
A、①② B、①④ C、①③ D、①③④13. 目前,许多烧烤店都改用机制炭作燃料,引燃机制炭可以使用固体酒精,盖灭机制炭可以使用炭灰,下列有关说法错误的是( ) A、酒精的燃烧是为了升高温度 B、炭灰可以隔绝空气而使机制炭熄灭 C、酒精的燃烧会升高机制炭的着火点 D、机制炭做成空心可以增大与空气的接触面积14. 溶液与生产、生活密切相关,下列有关溶液的说法正确的是( )A、5gNaCl完全溶解于100g水中,所得溶液中溶质的质量分数为5% B、固体物质的溶解度随温度升高一定增大 C、饱和硝酸钾溶液析出晶体后变为不饱和溶液 D、在其它条件不变时,氮气的溶解度随温度的升高而减小15. 下列推理错误的是( )
A、酒精的燃烧是为了升高温度 B、炭灰可以隔绝空气而使机制炭熄灭 C、酒精的燃烧会升高机制炭的着火点 D、机制炭做成空心可以增大与空气的接触面积14. 溶液与生产、生活密切相关,下列有关溶液的说法正确的是( )A、5gNaCl完全溶解于100g水中,所得溶液中溶质的质量分数为5% B、固体物质的溶解度随温度升高一定增大 C、饱和硝酸钾溶液析出晶体后变为不饱和溶液 D、在其它条件不变时,氮气的溶解度随温度的升高而减小15. 下列推理错误的是( )①燃烧过程中伴随着发光放热,所以有发光放热现象的变化一定是燃烧
②分子可以构成物质,所以物质一定是由分子构成的
③单质只含一种元素,所以含一种元素的物质一定是单质
④氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物
A、②③ B、①②③ C、①③④ D、①②③④16. 下列图像能正确反映其对应关系的是( )A、 电解水
B、
电解水
B、 加热一定质量的KClO3
C、
加热一定质量的KClO3
C、 两份完全相同的双氧水在有无MnO2的情况下产生O2
D、
两份完全相同的双氧水在有无MnO2的情况下产生O2
D、 红磷在密闭容器中燃烧
红磷在密闭容器中燃烧
二、填空题
-
17. 化学与我们的生活密切相关。(1)、用化学用语表示:
①氯化钠中的阳离子;
②灯泡里充入氮气;
③硅元素;
④标出氧化铝中铝元素化合价;
(2)、合理利用化学知识,生活更科学、更美好。①活性炭可以去除冰箱中的异味,说明它具有。
②洗洁精能除油污,是因为洗洁精具有作用。
18. “见著知微,见微知著”是化学思维方法。(1)、从宏观知微观。①50 mL水与50 mL乙醇混合后,溶液体积小于100 mL,微观解释为;
②气体X在氧气中燃烧生成氮气和水,X分子中一定含有的原子是(填化学符号)。
(2)、从微观知宏观。
①微粒A在化学反应中容易(填“得”或“失”)电子;微粒C的化学符号是。
②微粒A、B、C、D、E中,对应单质化学性质最稳定的是(填字母序号,下同),属于同一种元素的是。
19. 能源利用和环境保护是人类共同关注的问题。(1)、页岩气是以甲烷为主的可燃气体,甲烷完全燃烧的化学方程式是。(2)、垃圾分类从干湿分离开始”,这是北京市2019年正在大力推进的简易垃圾分类法。资料:“湿垃圾”是指植物类和厨余类垃圾,由于含水量高、易腐坏更适于发酵制沼气和肥料等。除湿垃圾外的其他垃圾为“干垃圾”,经分拣后可分别被再利用。下列生活垃圾应投入“干垃圾”桶的是(填序号)。A 菜叶、果皮 B 旧纸箱、玻璃瓶 C 剩菜、剩饭
(3)、氢气被认为是理想、清洁的燃料,氢气燃烧的化学方程式是。请再举出1种清洁能源:。20. 质量守恒定律的发现对化学的发展作出了巨大贡献.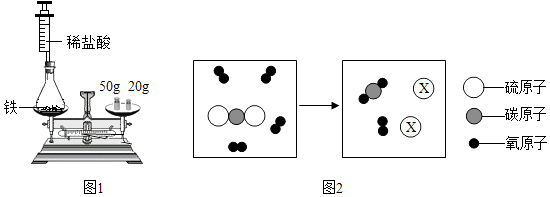 (1)、为验证质量守恒定律,小华设计如图1所示装置进行实验.
(1)、为验证质量守恒定律,小华设计如图1所示装置进行实验.实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图1所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到 , 从而验证了质量守恒定律.若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是 .
(2)、某反应的微观示意图如图2所示.①X的化学式是 .
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是 .
三、实验题
-
21. 溶液在生产、生活和实验中起着十分重要的作用。请回答下列问题:(1)、某同学配制100g溶质质量分数为5%的氯化钠溶液,请回答下列问题:
①若用氯化钠固体和水配制,实验步骤为计算、 、量取、溶解。
②若用溶质质量分数为20%的氯化钠溶液和水配置,则需20%的氯化钠溶液质量为g。
(2)、向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
①图一烧杯中的溶液一定属于饱和溶液的是(填序号);要使NaNO3不饱和溶液变为饱和可以采取的方法是。
②图二能表示NaNO3溶解度曲线的是(填“甲”或“乙”);甲、乙两物质溶解度曲线的交点的含义是。
22. 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法。(1)、实验室制取气体时,确定发生装置需要考虑的两种因素有(填序号)。A 反应物的状态 B 气体的密度
C 反应的条件 D 气体的溶解性
(2)、实验室部分装置如图(A﹣F)所示,请回答:(提示:装置C的多孔隔板,可以放置颗粒大小比孔径大的固体)

下表是初中几种常见气体的实验室制法,请你在横线上的空白处填上答案。
反应物
制取气体
发生装置(填字母)
收集装置(填字母)
大理石和稀盐酸
CO2
B或
锌粒和稀硫酸
H2
B
D或
高锰酸钾
O2
E或D
(3)、实验室常用高锰酸钾来制取氧气,其化学方程式为 ;(4)、小颖同学在探究二氧化碳性质时,将二氧化碳气体通入紫色石蕊溶液中,石蕊溶液很快变红色,原因是。(5)、若使用图1装置收集氧气,气体应从(填“a”或“b”)端通入。若通过连接图1和图2装置来测量氧气的体积,应将图2装置的c端与图1装置的(填“a”或“b”)端相连。一段时间后量筒内的凹液面如图3所示,则集得氧气的体积是mL。 23. 人类文明进步与金属材料发展关系十分密切,仔细审题分析后回答下列问题:(1)、实验一:小明运用控制变量的研究方法进行了以下系列实验按图1所示以“金属表面产生气泡的快慢”为标准来判断锌、铝、铁的活动性强弱,有同学认为不够合理,理由是 . 铝与稀盐酸刚接触时反应缓慢,一段时间后剧烈,产生气泡速率随着加快,其原因可能是 .(2)、实验二:为探究铁、铜、银三种金属活动性的顺序,小红提出按图2进行两步实验。
23. 人类文明进步与金属材料发展关系十分密切,仔细审题分析后回答下列问题:(1)、实验一:小明运用控制变量的研究方法进行了以下系列实验按图1所示以“金属表面产生气泡的快慢”为标准来判断锌、铝、铁的活动性强弱,有同学认为不够合理,理由是 . 铝与稀盐酸刚接触时反应缓慢,一段时间后剧烈,产生气泡速率随着加快,其原因可能是 .(2)、实验二:为探究铁、铜、银三种金属活动性的顺序,小红提出按图2进行两步实验。
a.试管①中发生反应的化学方程式为 , 该反应的基本类型是。
b.试管②中现象是 ;
(3)、铁是目前世界年产量最多的金属。如图3是实验室演示炼铁的实验装置图,回答下列问题。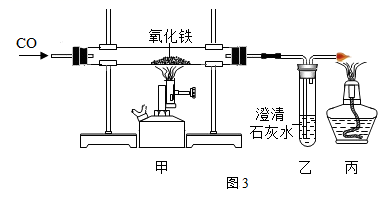
①写出甲处玻璃管中反应的化学方程式:。
②图3实验处理尾气利用了一氧化碳的可燃性,与氧化铁反应利用了一氧化碳的。
四、计算题
-
24. 某品牌补铁剂(见下图)的使用说明书部分内容如下:

(成 分)本品每袋含富马酸亚铁0.1g,富马酸亚铁的化学式:C4H2FeO4
(功能主治)用于各种原因(如慢性失血、营养不良)引起的缺铁性贫血
(用法用量)口服。儿童:一次0.1g,一日1-3次; 成人:一次0.2g,一日3-4次
(1)、富马酸亚铁含有种元素,其中碳、氢元素的质量比为。(2)、富马酸亚铁中铁元素的质量分数为。25. 某化学兴趣小组为了测定当地的石灰石(该固体的主要成分是CaCO3)中的CaCO3的质量分数,他们做了如下实验:取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用稀盐酸的质量与剩余固体的质量关系如图所示,请根据图中的数据进行计算: (1)、石灰石样品中CaCO3的质量为克。(2)、当稀盐酸加到克时,样品与稀盐酸恰好完全反应。(3)、求稀盐酸的质量分数(请根据化学方程式写出完整的计算步骤)
(1)、石灰石样品中CaCO3的质量为克。(2)、当稀盐酸加到克时,样品与稀盐酸恰好完全反应。(3)、求稀盐酸的质量分数(请根据化学方程式写出完整的计算步骤)