2016年高考理综真题试卷(化学部分)(新课标Ⅲ卷)
试卷更新日期:2016-06-15 类型:高考真卷
一、选择题.
-
1. 化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
次氯酸盐具有氧化性
漂白粉漂白织物
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
A、A B、B C、C D、D -
2. 下列说法错误的是( )A、乙烷室温下能与浓盐酸发生取代反应 B、乙烯可以用作生产食品包装材料的原料 C、乙醇室温下在水中的溶解度大于溴乙烷 D、乙酸与甲酸甲酯互为同分异构体
-
3. 下列有关实验的操作正确的是( )
实验
操作
A
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
B
排水法收集KMnO4分解产生的O2
先熄灭酒精灯,后移除导管
C
浓盐酸与MnO2反应制备纯净Cl2
气体产物先通过浓硫酸,后通过饱和食盐水
D
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
A、A B、B C、C D、D -
4.
已知异丙苯的结构简式如图,下列说法错误的是( )
 A、异丙苯的分子式为C9H12 B、异丙苯的沸点比苯高 C、异丙苯中碳原子可能都处于同一平面 D、异丙苯和苯为同系物
A、异丙苯的分子式为C9H12 B、异丙苯的沸点比苯高 C、异丙苯中碳原子可能都处于同一平面 D、异丙苯和苯为同系物 -
5. 锌﹣空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH﹣+2H2O═2Zn(OH)42﹣ . 下列说法正确的是( )A、充电时,电解质溶液中K+向阳极移动 B、充电时,电解质溶液中c(OH﹣)逐渐减小 C、放电时,负极反应为:Zn+4OH﹣﹣2e﹣═Zn(OH)42﹣ D、放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
-
6. 四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A、简单离子半径:W<X<Z B、W与X形成的化合物溶于水后溶液呈碱性 C、气态氢化物的热稳定性:W<Y D、最高价氧化物的水化物的酸性:Y>Z -
7. 下列有关电解质溶液的说法正确的是( )A、向0.1mol•L﹣1 CH3COOH溶液中加入少量水,溶液中 减小 B、将CH3COONa溶液从20℃升温至30℃,溶液中 增大 C、向盐酸中加入氨水至中性,溶液中 >1 D、向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 不变
二、解答题.
-
8.
过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题:
(一)碳酸钙的制备
 (1)、步骤①加入氨水的目的是 . 小火煮沸的作用是使沉淀颗粒长大,有利于 .(2)、
(1)、步骤①加入氨水的目的是 . 小火煮沸的作用是使沉淀颗粒长大,有利于 .(2)、如图是某学生的过滤操作示意图,其操作不规范的是(填标号).

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加过过滤速度
(3)、(二)过氧化钙的制备

步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈性(填“酸”、“碱”或“中”).将溶液煮沸,趁热过滤,将溶液煮沸的作用是 .
(4)、步骤③中反应的化学方程式为 , 该反应需要在冰浴下进行,原因是 .(5)、将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是 .(6)、制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是 , 产品的缺点是 . -
9. 煤燃烧排放的烟含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:(1)、NaClO2的化学名称为 .(2)、在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10﹣3mol•L﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子
SO42﹣
SO32﹣
NO3﹣
NO2﹣
Cl﹣
c/(mol•L﹣1)
8.35×10﹣4
6.87×10﹣6
1.5×10﹣4
1.2×10﹣5
3.4×10﹣3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 . 增加压强,NO的转化率(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是 .
(3)、在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压p0如图所示.

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”、“不变”或“减小”).
②反应ClO2﹣+2SO32﹣═2SO42﹣+Cl﹣的平衡常数K表达式为 .
(4)、如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .
②已知下列反应:
SO2(g)+2OH﹣(aq)═SO32﹣(aq)+H2O(l)△H1
ClO﹣(aq)+SO32﹣(aq)═SO42﹣(aq)+Cl﹣(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42﹣(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO﹣(aq)+2OH﹣(aq)═CaSO4(s)+H2O(l)+Cl﹣(aq)的△H= .
-
10.
以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂.从废钒催化剂中回收V2O5既避免污染环境
又有利于资源综合利用.废钒催化剂的主要成分为:
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)、“酸浸”时V2O5转化为VO2+ , 反应的离子方程式为 , 同时V2O4转成VO2+ . “废渣1”的主要成分是 .(2)、“氧化”中欲使3 mol的VO2+变为VO2+ , 则需要氧化剂KClO3至少为mol.(3)、“中和”作用之一是使钒以V4O124﹣形式存在于溶液中.“废渣2”中含有 .(4)、“离子交换”和“洗脱”可简单表示为:4ROH+V4O124﹣
 R4V4O12+4OH﹣(以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”).(5)、“流出液”中阳离子最多的是 .(6)、“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 .
R4V4O12+4OH﹣(以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”).(5)、“流出液”中阳离子最多的是 .(6)、“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 . -
11.
【[化学——选修2:化学与技术】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.

回答下列问题
(1)、废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为 . 粉碎过筛的目的是 .(2)、酸浸时最合适的酸是 , 写出铁锈与酸反应的离子方程式 .(3)、反应釜中加入氧化剂的作用是 , 下列氧化剂中最合适的是(填标号).A.KMnO4 B.Cl2 C.H2 O2 D.HNO3
(4)、聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则 .(5)、相对于常压蒸发,减压蒸发的优点是 .(6)、盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为B= (n为物质的量).为测量样品的B值,取样品m g,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c mol•L﹣1的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液V mL.按上述步骤做空白对照试验,消耗NaOH溶液V0 mL,已知该样品中Fe的质量分数w,则B的表达式为 .
-
12. 【化学-选修3:物质结构与性质】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)、写出基态As原子的核外电子排布式 .(2)、根据元素周期律,原子半径GaAs,第一电离能GaAs.(填“大于”或“小于”)(3)、AsCl3分子的立体构型为 , 其中As的杂化轨道类型为 .(4)、GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 .(5)、GaAs的熔点为1238℃,密度为ρ g•cm﹣3 , 其晶胞结构如图所示.
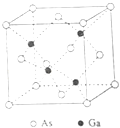
该晶体的类型为 , Ga与As以键键合.Ga和As的摩尔质量分别为MGa g•mol﹣1和MAs g•mol﹣1 , 原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为 .
-
13.
【化学-选修5:有机化学基础】端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应.2R﹣C≡C﹣H
 R﹣C≡C﹣C≡C﹣R+H2
R﹣C≡C﹣C≡C﹣R+H2该反应在研究新型发光材料、超分子化学等方面具有重要价值.下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)、B的结构简式为 , D的化学名称为 .(2)、①和③的反应类型分别为、 .(3)、E的结构简式为 . 用1mol E合成1,4﹣二苯基丁烷,理论上需要消耗氢气mol.(4)、化合物()也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .(5)、芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式 .(6)、写出用2﹣苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线 .
