福建省龙岩市上杭县2019-2020学年九年级上学期化学期末考试试卷
试卷更新日期:2020-11-10 类型:期末考试
一、单选题
-
1. “绿水青山就是金山银山”,垃圾分类处理有利于生态文明建设。废弃物中,易拉罐属于( )A、可回收物 B、餐厨垃圾 C、有害垃圾 D、其它垃圾2. “一带一路”是我国新时代经济发展的重要战略。下列技术中不属于化学变化的是( )A、蚕丝织布 B、谷物酿酒 C、烧制瓷器 D、冶炼青铜3. 下列图示实验操作中,正确的是( )A、
 B、
B、 C、
C、 D、
D、 4. 关于氧气和二氧化碳的说法正确的是( )A、构成:都是由分子构成,且都含有氧分子 B、性质:常温下均为气体,且都易溶于水 C、用途:氧气可用作燃料,二氧化碳可用作化工原料 D、转化:在自然界中氧气和二氧化碳可以相互转化5. 下列物质由分子构成的是()A、金刚石 B、铁 C、氯化钠 D、氧气6. 2019年中国水周的主题为“坚持节水优先,强化水资源管理”。下列有关水的认识正确的是( )A、生活中常用煮沸的方法降低水的硬度 B、过滤可以除去水中所有的杂质 C、电解水实验说明水由氢气和氧气组成 D、农业上大水漫灌农作物7. 下列四支试管中,铁钉锈蚀最快的是( )A、
4. 关于氧气和二氧化碳的说法正确的是( )A、构成:都是由分子构成,且都含有氧分子 B、性质:常温下均为气体,且都易溶于水 C、用途:氧气可用作燃料,二氧化碳可用作化工原料 D、转化:在自然界中氧气和二氧化碳可以相互转化5. 下列物质由分子构成的是()A、金刚石 B、铁 C、氯化钠 D、氧气6. 2019年中国水周的主题为“坚持节水优先,强化水资源管理”。下列有关水的认识正确的是( )A、生活中常用煮沸的方法降低水的硬度 B、过滤可以除去水中所有的杂质 C、电解水实验说明水由氢气和氧气组成 D、农业上大水漫灌农作物7. 下列四支试管中,铁钉锈蚀最快的是( )A、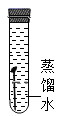 B、
B、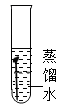 C、
C、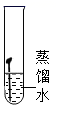 D、
D、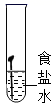 8. 每年三月的最后一个星期一是全国中小学安全教育日。下列说法错误的( )A、煤矿的矿井要加强通风,防止发生爆炸 B、炒菜时油锅着火,立即盖上锅盖灭火 C、厨房天然气泄露,可打开抽油烟机排气 D、进入久未开启的地窖,要做灯火实验9. 某种药物的化学式为C6H9O6N,下列有关该药物的说法错误的是()A、由四种元素组成 B、相对分子质量为191 C、1个分子由22个原子构成 D、碳、氧两种元素的质量比为1:110. 如图是利用气压传感器测定红磷燃烧时集气瓶内气压变化的实验装置。点燃红磷,待红磷熄灭并冷却后,打开止水夹。瓶内气压的变化如图。下列说法错误的是( )
8. 每年三月的最后一个星期一是全国中小学安全教育日。下列说法错误的( )A、煤矿的矿井要加强通风,防止发生爆炸 B、炒菜时油锅着火,立即盖上锅盖灭火 C、厨房天然气泄露,可打开抽油烟机排气 D、进入久未开启的地窖,要做灯火实验9. 某种药物的化学式为C6H9O6N,下列有关该药物的说法错误的是()A、由四种元素组成 B、相对分子质量为191 C、1个分子由22个原子构成 D、碳、氧两种元素的质量比为1:110. 如图是利用气压传感器测定红磷燃烧时集气瓶内气压变化的实验装置。点燃红磷,待红磷熄灭并冷却后,打开止水夹。瓶内气压的变化如图。下列说法错误的是( ) A、AB段气压不变是红磷没有开始燃烧 B、BC段气压增大是因为燃烧放热 C、CD段气压减小是因为集气瓶内氧气不断被消耗 D、DE段气压增大是因为烧杯中水进入集气瓶后,气体体积增大
A、AB段气压不变是红磷没有开始燃烧 B、BC段气压增大是因为燃烧放热 C、CD段气压减小是因为集气瓶内氧气不断被消耗 D、DE段气压增大是因为烧杯中水进入集气瓶后,气体体积增大二、填空题
-
11. 在生产生活中,你会发现“化学就在身边”。(1)、武德合金常用作保险丝,是因为合金的熔点比组成它的纯金属的熔点要(填“高”或“低”)。(2)、校园里,在远处就能闻到桂花的香味,说明分子。(3)、牛奶可预防幼儿及青少年因缺元素患佝偻病和发育不良。(4)、生活中,人们用嘴吹灭蜡烛,其灭火的原理是(5)、生活中作调味用的食盐主要成分是。(填化学式)(6)、超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气2KO2+2H2O=2KOH+X+O2↑, X的化学式为12. “珍惜、节约和爱护水”是每个公民应尽的义务和责任。试回答(1)、用如图所示装置进行电解水的实验,a、b两玻璃管中收集到的气体体积比为 , 反应的化方程式为。
 (2)、饮用硬度过大的水不利于人体键康,在生活中可用区分硬水和软水;(3)、如图是自来水厂净化水的主要步骤。其中X试剂可以是步骤④的作用是
(2)、饮用硬度过大的水不利于人体键康,在生活中可用区分硬水和软水;(3)、如图是自来水厂净化水的主要步骤。其中X试剂可以是步骤④的作用是 (4)、请列举一例生活中节约用水的具体做法。13. 2019年是国际化学元素周期表年。(1)、据有关科研机构介绍,国内5G通信芯片是用氮化镓材料制成。如图是氮元素在元素周期表中的信息以及镓原子的结构示意图,试回答:
(4)、请列举一例生活中节约用水的具体做法。13. 2019年是国际化学元素周期表年。(1)、据有关科研机构介绍,国内5G通信芯片是用氮化镓材料制成。如图是氮元素在元素周期表中的信息以及镓原子的结构示意图,试回答:
①氮原子核外电子数为 ;相对原子质量为。
②图中x=镓原子化学反应中容易(填得到或失去)电子。
③已知氮化镓的化学式为GaN,其中镓的化合价为+3,则氮元素化合价为
(2)、汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程如图所示。试回答:
①反应前后铂催化剂的质量(填改变或不变)反应过程中,保持不变的微粒是 (填“分子”或“原子”),
②反应中属于单质的物质化学式为
参加反应的两种物质的分子个数之比为 。
14. 变化观念和平衡思想是化学核心素养之一。化学变化中,物质在一定条件下可发生转化。(注:“ ”表示某种物质通过一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)回答下列问题:(1)、已知 ,若乙是五氧化二磷,则甲可以是 (2)、如图甲和乙在一定条件下相互转化。
,若乙是五氧化二磷,则甲可以是 (2)、如图甲和乙在一定条件下相互转化。
其中甲为二氧化碳,乙为碳酸钙,写出路线Ⅰ反应的化学方程式:。
(3)、若A,B,C均含有同一种元素,B、C组成元素相同,C的固体俗称“干冰”,则B的化学式是。
三、流程题
-
15. 2019年我国高铁总里程将突破3万公里,提前一年实现《中长期铁路网规划》的宏伟目标。(1)、动车电路中的导线大多选用铜制造的,这是利用了铜的性。(2)、动车表面喷漆主要是为了防止外壳腐蚀,其原理是。(3)、铁路焊接的原理为:高温下,铝与氧化铁(Fe2O3)反应得到熔融的铁与氧化铝。该反应的化学方程式为 , 基本反应类型为反应。(4)、某工厂将生产过程中产生的含铜废料按图进行回收并合理应用:

①步骤Ⅰ反应的化学方程式为:
②古代“湿法冶金”的原理与图中步骤(填“Ⅰ”、“Ⅱ”或“Ⅲ”)的反应原理相同。
③从“不溶物A”中提纯铜单质可用的方法有
四、实验题
-
16. 如图是实验室制取气体的常用装置。
 (1)、写出标示仪器的名称:a 、b 。(2)、实验室用高锰酸钾制取氧气,应选用的发生装置是(填序号),反应的化学方程式为;若用排水法收集氧气,导管口刚有气泡冒出时,不能就开始收集,原因是。(3)、实验室制取二氧化碳的化学方程式为一般采用向上排空法收集,则收集时验满的方法是:若用C 、D装置来测量反应生成的CO2体积,则与e端管口相连的是(填“c”或“d”),植物油上方原有的空气对实验结果(填“有”或“无”)明显影响。
(1)、写出标示仪器的名称:a 、b 。(2)、实验室用高锰酸钾制取氧气,应选用的发生装置是(填序号),反应的化学方程式为;若用排水法收集氧气,导管口刚有气泡冒出时,不能就开始收集,原因是。(3)、实验室制取二氧化碳的化学方程式为一般采用向上排空法收集,则收集时验满的方法是:若用C 、D装置来测量反应生成的CO2体积,则与e端管口相连的是(填“c”或“d”),植物油上方原有的空气对实验结果(填“有”或“无”)明显影响。五、科学探究题
-
17. 实验室中用一氧化碳还原纯净的Fe2O3粉末。

反应后装置中玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小军同学提出了质疑,于是同学们提出查阅资料,寻求真理。
(查阅资料)一氧化碳还原Fe2O3的固体产物的成分与反应温度、时间有关,产物可能是Fe3O4、FeO、Fe
几种物质的性质
物质性质
Fe
Fe2O3
FeO
Fe3O4
颜色
黑色
红色
黑色
黑色
能否被磁铁吸引
能
不能
不能
能
已知反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,FeCl3溶液呈棕黄色
(1)、(实验1)该小组同学将反应后的黑色固体研细后,用磁铁吸引,发现黑色粉末全部能被吸引,则该黑色粉末中不可能含有Fe2O3和(填化学式)。
黑色固体粉末的成分是什么?
猜想Ⅰ:全部为Fe
猜想Ⅱ:全部为Fe3O4
猜想Ⅲ:(填化学式)
(2)、实验:将黑色粉末加入到足量的稀盐酸中,全部溶解,观察现象:①有无色气体产生,
②溶液呈棕黄色 。
由上述实验现象,得出上述猜想正确。
(3)、(评价与反思)装置中澄清石灰水的作用是;若撤出装置中点燃的酒精灯可能造成的后果。(4)、(实验2)采用实验1后的剩余物可制备三氯化铁,三氯化铁(FeCl3)可用于金属蚀刻等。(查阅资料)①通入Cl2可将FeCl2溶液转化成FeCl3溶液。
②FeCl3蚀刻铜反应原理:废铜电路板上的铜与FeCl3溶液反应生成FeCl2和CuCl2
③FeCl3能使KSCN溶液变红色,而FeCl2与CuCl2不能。
将实验1后的剩余物进行分步实验,操作过程中氯化铁的质量变化如图:

操作Ⅰ可除去固体残渣,该操作的名称是。
(5)、通过操作Ⅱ,氯化铁的质量增加的原因是。(6)、通过操作Ⅲ,得到d溶液,检验d溶液中是否还含有氯化铁的方法是。六、计算题
-
18. “人工固氮”每年能生产11.9亿吨氨(NH3),反应原理为:N2+3H2 2NH3。(1)、根据化学方程式计算:“人工固氮”每年固定氮气的质量是?(2)、每年全球“雷电固氮”约能固定0.98亿吨氮气,“人工固氮”固定氮气的质量相当于“雷电固氮”的倍。
-
-
-