2016年高考理综真题试卷(化学部分)(北京卷)
试卷更新日期:2016-06-13 类型:高考真卷
一、选择题.
-
1. 我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )A、徐光宪建立稀土串级萃取理论 B、屠呦呦发现抗疟新药青蒿素 C、闵恩泽研发重油裂解催化剂 D、侯德榜联合制碱法2.
下列中草药煎制步骤中,属于过滤操作的是( )
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存



 A、A B、B C、C D、D3. 下列食品添加剂中,其试用目的与反应速率有关的是( )A、抗氧化剂 B、调味剂 C、着色剂 D、增稠剂4. 在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表:
A、A B、B C、C D、D3. 下列食品添加剂中,其试用目的与反应速率有关的是( )A、抗氧化剂 B、调味剂 C、着色剂 D、增稠剂4. 在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表:对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
25
47
6
下列说法不正确的是( )
A、该反应属于取代反应 B、甲苯的沸点高于144℃ C、用蒸馏的方法可将苯从反应所得产物中首先分离出来 D、从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来5.K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O⇌2CrO42﹣(黄色)+2H+ . 用K2Cr2O7溶液进行下列实验:

结合实验,下列说法不正确的是( )
A、①中溶液橙色加深,③中溶液变黄 B、②中Cr2O72﹣被C2H5OH还原 C、对比②和④可知K2Cr2O7酸性溶液氧化性强 D、若向④中加入70%H2SO4溶液至过量,溶液变为橙色6.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
 A、①代表滴加H2SO4溶液的变化曲线 B、b点,溶液中大量存在的离子是Na+、OH﹣ C、c点,两溶液中含有相同量的OH﹣ D、a、d两点对应的溶液均显中性7.
A、①代表滴加H2SO4溶液的变化曲线 B、b点,溶液中大量存在的离子是Na+、OH﹣ C、c点,两溶液中含有相同量的OH﹣ D、a、d两点对应的溶液均显中性7.用石墨电极完成下列电解实验.
实验一
实验二
装置

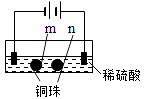
现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生;…
下列对实验现象的解释或推测不合理的是( )
A、a、d处:2H2O+2e﹣═H2↑+2OH﹣ B、b处:2Cl﹣﹣2e﹣═Cl2↑ C、c处发生了反应:Fe﹣2e﹣═Fe2+ D、根据实验一的原理,实验二中m处能析出铜二、解答题(共4小题,满分58分)
-
8.
功能高分子P的合成路线如下:
 (1)、A的分子式是C7H8 , 其结构简式是 .(2)、试剂a是 .(3)、反应③的化学方程式: .(4)、E的分子式是C6H10O2 . E中含有的官能团: .(5)、反应④的反应类型是 .(6)、反应⑤的化学方程式: .(7)、
(1)、A的分子式是C7H8 , 其结构简式是 .(2)、试剂a是 .(3)、反应③的化学方程式: .(4)、E的分子式是C6H10O2 . E中含有的官能团: .(5)、反应④的反应类型是 .(6)、反应⑤的化学方程式: .(7)、已知:2CH3CHO

以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件).
9.用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
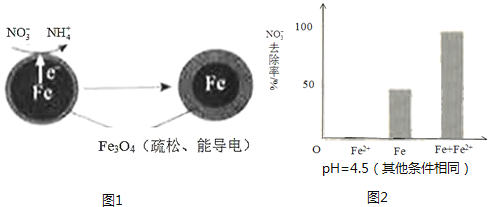 (1)、Fe还原水体中NO3﹣的反应原理如图1所示.
(1)、Fe还原水体中NO3﹣的反应原理如图1所示.①作负极的物质是 .
②正极的电极反应式是 .
(2)、将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
接近100%
<50%
24小时pH
接近中性
接近中性
铁的最终物质形态


pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)、实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)、其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
约10%
约3%
1小时pH
接近中性
接近中性
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
10.以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用.其工作流程如下:
 (1)、过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是 .(2)、过程Ⅰ中,Fe2+催化过程可表示为:
(1)、过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是 .(2)、过程Ⅰ中,Fe2+催化过程可表示为:i:2Fe2++PbO2+4H++SO42﹣═2Fe3++PbSO4+2H2O
ii:…
①写出ii的离子方程式: .
②下列实验方案可证实上述催化过程.将实验方案补充完整.
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红.
b. .
(3)、PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)⇌NaHPbO2(aq),其溶解度曲线如图所示.

①过程Ⅱ的目的是脱硫.滤液1经处理后可在过程Ⅱ中重复使用,其目的是(选填序号).
A.减小Pb的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:
11.以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
实验
试剂
现象
滴管
试管

0.2 mol•L﹣1 Na2SO3溶液
饱和Ag2SO4溶液
Ⅰ.产生白色沉淀
0.2 mol•L﹣1 CuSO4
Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀
0.1 mol•L﹣1 Al2(SO4)3溶液
Ⅲ.开始无明显变化,继续滴加产生白色沉淀
(1)、经检验,现象Ⅰ中的白色沉淀是Ag2SO3 . 用离子方程式解释现象Ⅰ: .(2)、经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ . 已知:Cu+
 Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+ CuI↓(白色)+I2 .
CuI↓(白色)+I2 . ①用稀硫酸证实沉淀中含有Cu+的实验现象是 .
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ .

a.白色沉淀A是BaSO4 , 试剂1是 .
b.证实沉淀中含有Cu+和SO32﹣的理由是 .
(3)、已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42﹣ , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和 .
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:

步骤二:(按图形式呈现).
b.假设ii成立的实验证据是
(4)、根据实验,亚硫酸盐的性质有 . 盐溶液间反应的多样性与有关.