2016年高考理综真题试卷(化学部分)(天津卷)
试卷更新日期:2016-06-13 类型:高考真卷
一、选择题(共6小题,每小题6分,满分36分)
-
1.
根据所给信息和标志,判断下列说法错误的是( )
A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
碳酸氢钠药片



古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
A、A B、B C、C D、D2. 下列对氨基酸和蛋白质的描述正确的是( )A、蛋白质水解的最终产物是氨基酸 B、氨基酸和蛋白质遇重金属离子均会变性 C、α﹣氨基丙酸与α﹣氨基苯丙酸混合物脱水成肽,只生成2种二肽 D、氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动3. 下列叙述正确的是( )A、使用催化剂能够降低化学反应的反应热(△H) B、金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 C、原电池中发生的反应达平衡时,该电池仍有电流产生 D、在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小4. 下列实验的反应原理用离子方程式表示正确的是( )A、室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3•H2O+H3O+ B、用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑ C、用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3﹣→
+2HCO3﹣→  +2H2O+2CO2↑
D、用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
5.
+2H2O+2CO2↑
D、用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
5.下列选用的仪器和药品能达到实验目的是( )
A
B
C
D


NaHSO3溶液


制乙炔的发生装置
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7标准溶液
A、A B、B C、C D、D6.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L﹣1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
 A、三种酸的电离常数关系:KHA>KHB>KHD B、滴定至P点时,溶液中:c(B﹣)>c(Na+)>c(HB)>c(H+)>c(OH﹣) C、pH=7时,三种溶液中:c(A﹣)=c(B﹣)=c(D﹣) D、当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH﹣)﹣c(H+)
A、三种酸的电离常数关系:KHA>KHB>KHD B、滴定至P点时,溶液中:c(B﹣)>c(Na+)>c(HB)>c(H+)>c(OH﹣) C、pH=7时,三种溶液中:c(A﹣)=c(B﹣)=c(D﹣) D、当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH﹣)﹣c(H+)二、解答题(共4小题,满分64分)
-
7. 如表为元素周期表的一部分.
碳
氮
Y
X
硫
Z
回答下列问题:
(1)、Z元素在周期表中的位置为 .(2)、表中元素原子半径最大的是(写元素符号) .(3)、下列事实能说明Y元素的非金属性比S元素的非金属性强的是 .a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)、X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为﹣69℃和58℃.写出该反应的热化学方程式: .(5)、碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 . Q与水反应的化学方程式为 .(6)、铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol•L﹣1 NaOH溶液和1mol O2 , 则两种气体的分子式及物质的量分别为 , 生成硫酸铜物质的量为 .8.己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一,根据该合成路线回答下列问题:
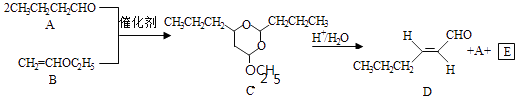
已知
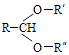
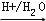 RCHO+R′OH+R″OH(1)、A的名称是;B分子中的共面原子数目最多为;C分子中与环相连的三个基团中,不同化学环境的氢原子共有种.(2)、D中含氧官能团的名称是 . 写出检验该官能团的化学反应方程式: .(3)、E为有机物,能发生的反应有:
RCHO+R′OH+R″OH(1)、A的名称是;B分子中的共面原子数目最多为;C分子中与环相连的三个基团中,不同化学环境的氢原子共有种.(2)、D中含氧官能团的名称是 . 写出检验该官能团的化学反应方程式: .(3)、E为有机物,能发生的反应有:a.聚合反应 b.加成反应 c.消去反应 d.取代反应
(4)、B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:(5)、以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整.
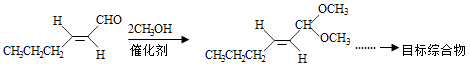 (6)、问题(5)的合成路线中的第一步反应的目的是 .9.
(6)、问题(5)的合成路线中的第一步反应的目的是 .9.水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L﹣1 . 我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L﹣1 . 某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.

Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH﹣═2MnO(OH)2↓
酸性条件下,MnO(OH)2将I﹣氧化为I2:②MnO(OH)2+I﹣+H+→Mn2++I2+H2O(未配平)
用Na2S2O3标准溶液滴定生成的I2;③2S2O32﹣+I2═S4O62﹣+2I﹣
Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2 .
b.向烧瓶中加入200mL水样.
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量)开启搅拌器,至反应①完全.
d.搅拌并向烧瓶中加入2mL H2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性.
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol•L﹣1 Na2S2O3溶液进行滴定,记录数据.f…
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化).
回答下列问题:
(1)、配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为 .(2)、在橡胶塞处加入水样及有关试剂应选择的仪器是 .①滴定管 ②注射器 ③量筒
(3)、搅拌的作用是 .(4)、配平反应②的方程式,其化学计量数依次为 .(5)、步骤f为 .(6)、步骤e中达到滴定终点的标志为 . 若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=mg•L﹣1(保留一位小数).作为饮用水源,此次测得DO是否达标:(填“是”或“否”)(7)、步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个) .10.氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
 (1)、与汽油相比,氢气作为燃料的优点是(至少答出两点).但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: .(2)、氢气可用于制备H2O2 . 已知:
(1)、与汽油相比,氢气作为燃料的优点是(至少答出两点).但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: .(2)、氢气可用于制备H2O2 . 已知:H2(g)+A(l)═B(l)△H1
O2(g)+B(l)═A(l)+H2O2(l)△H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)═H2O2(l)的△H=0(填“>”或“=”)
(3)、在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)⇌MHx+2y(s)△H<0达到化学平衡.下列有关叙述正确的是a.容器内气体压强保持不变
b.吸收ymol H2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
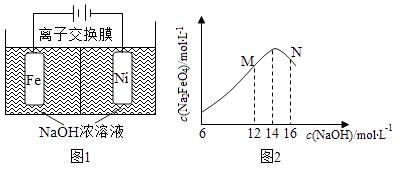
(4)、利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 .(5)、化工生产的副产氢也是氢气的来源,电解法制取有广泛用途的Na2FeO4 . 同时获得氢气:Fe+2H2O+2OH﹣→FeO42﹣+3H2↑,装置如图所示,装置通电后,铁电极附近生成紫红色FeO42﹣ , 镍电极有气泡产生.若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.已知:Na2FeO4只在强碱性条件下稳定,易被H2还原.
①电解一段时间后,c(OH﹣)降低的区域在(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因为 .
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因 .