浙江省台州市2020-2021学年九年级上学期科学第一次月考试卷(到第2章结束)
试卷更新日期:2020-11-06 类型:月考试卷
一、选择题(每题4分,共60分)
-
1. 本次化学考试用的纸张,下列性质属于其化学性质的是( )A、白色 B、可燃 C、易撕碎 D、不溶于水2. 下列物质属于盐的是( )A、纯碱 B、烧碱 C、火碱 D、盐酸3. 化学实验室对药品存放有一定要求,下图所示白磷存放符合要求的是 ( )A、
 B、
B、 C、
C、 D、
D、 4. 下列对实验意外事故处理错误的是( )A、硫酸洒在实验台上,立即用烧碱溶液冲洗 B、实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓 C、酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭 D、浓硫酸沾皮肤上,先用干抹布擦去,再用大量水冲洗,最后涂上碳酸氢钠溶液5. 如下图所示的实验操作或装置正确的是( )A、倾倒液体
4. 下列对实验意外事故处理错误的是( )A、硫酸洒在实验台上,立即用烧碱溶液冲洗 B、实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓 C、酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭 D、浓硫酸沾皮肤上,先用干抹布擦去,再用大量水冲洗,最后涂上碳酸氢钠溶液5. 如下图所示的实验操作或装置正确的是( )A、倾倒液体 B、氢气还原氧化铜
B、氢气还原氧化铜  C、加热液体
C、加热液体  D、稀释浓硫酸
D、稀释浓硫酸  6. 下列装置中,不添其他仪器,不改变装置结构,不能检查装置是否漏气的是( )A、
6. 下列装置中,不添其他仪器,不改变装置结构,不能检查装置是否漏气的是( )A、 B、
B、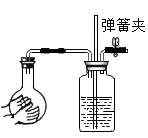 C、
C、 D、
D、 7. 把铝箔放入CuCl2溶液中,铝箔表面覆盖了红色物质,一会儿又有大量气泡冒出。同学们对“放出气体”这一异常现象进行猜想、实验。其中没有价值的是( )A、小宇同学推测气体是氢气并检验 B、小琪同学猜想CuCl2溶液呈酸性并测定 C、小寒同学认为气体是氨气并检验 D、小梁同学认为试剂变质,更换后再实验8. 将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )A、FeCl2、NaCl、KNO3 B、CaCl2、HCl、NaNO3 C、K2CO3、Mg(NO3)2、NaOH D、KOH、NaCl、(NH4)2SO49. 向等质量锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是( )A、
7. 把铝箔放入CuCl2溶液中,铝箔表面覆盖了红色物质,一会儿又有大量气泡冒出。同学们对“放出气体”这一异常现象进行猜想、实验。其中没有价值的是( )A、小宇同学推测气体是氢气并检验 B、小琪同学猜想CuCl2溶液呈酸性并测定 C、小寒同学认为气体是氨气并检验 D、小梁同学认为试剂变质,更换后再实验8. 将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是( )A、FeCl2、NaCl、KNO3 B、CaCl2、HCl、NaNO3 C、K2CO3、Mg(NO3)2、NaOH D、KOH、NaCl、(NH4)2SO49. 向等质量锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是( )A、 B、
B、 C、
C、 D、
D、 10. 下列涉及科学观点有关说法正确的是( )A、转化观:水可以变成油 B、微粒观:水是由氢原子和氧原子构成的 C、结构观:氢原子和氢离子的质子数相同,属于同种元素 D、守恒观:1g氢气和9g氧气反应生成10g水11. 推理是一种重要的学习方法。下列推理中正确的是( )A、物质与氧气发生的反应都是氧化反应,则氧化反应一定要有氧气参加 B、单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 C、中和反应生成盐和水,则生成盐和水的反应一定是中和反应 D、碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定呈碱性12. 归纳法也是学习化学的重要方法,下列图示正确的是( )A、化学反应分类
10. 下列涉及科学观点有关说法正确的是( )A、转化观:水可以变成油 B、微粒观:水是由氢原子和氧原子构成的 C、结构观:氢原子和氢离子的质子数相同,属于同种元素 D、守恒观:1g氢气和9g氧气反应生成10g水11. 推理是一种重要的学习方法。下列推理中正确的是( )A、物质与氧气发生的反应都是氧化反应,则氧化反应一定要有氧气参加 B、单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 C、中和反应生成盐和水,则生成盐和水的反应一定是中和反应 D、碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定呈碱性12. 归纳法也是学习化学的重要方法,下列图示正确的是( )A、化学反应分类 B、物质分类
B、物质分类  C、地壳中元素含量
C、地壳中元素含量  D、金属的化学性质
D、金属的化学性质  13. 甲、乙、丙、丁四种溶液中,分别含有Ba2+,Mg2+,Na+ , H+ , OH-,Cl- , CO32-,SO42-中的一种阳离子和一种阴离子,为确定四种溶液中分别含有哪种阳离子和阴离子,进行了下面的实验:将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成;将乙、丁溶液混合,有气泡产生;向丙溶液中滴入硝酸银溶液,可明显观察到白色沉淀,加稀硝酸后,沉淀不消失。以下结论不正确的是( )A、甲溶液中一定含有钡离子 B、乙溶液中可能含有硫酸根离子 C、丙溶液中一定含有氯离子 D、丁溶液中一定含有钠离子14. 将一定量的锌粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,将滤渣放入稀盐酸溶液里,有气泡产生。则下列情况不可能存在的是( )A、滤渣是Ag、Cu、Zn B、滤液中含有Zn2+、Mg2+、 C、滤渣是Ag、Cu、Mg D、金属活动性顺序是Ag<Cu<Zn<Mg15. 通过海水晒盐的方法得到的仅仅是粗盐,其中还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在。为将这些杂质除净,可向食盐溶液中加过量的氢氧化钠溶液、碳酸钠溶液、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过滤、蒸发得到精盐。下列操作及加入溶液顺序错误的是( )A、Na2CO3、BaCl2、NaOH、过滤、HCl B、NaOH、BaCl2、Na2CO3、过滤、HCl C、BaCl2、Na2CO3、NaOH、过滤、HCl D、BaCl2、NaOH、Na2CO3、过滤、HCl
13. 甲、乙、丙、丁四种溶液中,分别含有Ba2+,Mg2+,Na+ , H+ , OH-,Cl- , CO32-,SO42-中的一种阳离子和一种阴离子,为确定四种溶液中分别含有哪种阳离子和阴离子,进行了下面的实验:将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成;将乙、丁溶液混合,有气泡产生;向丙溶液中滴入硝酸银溶液,可明显观察到白色沉淀,加稀硝酸后,沉淀不消失。以下结论不正确的是( )A、甲溶液中一定含有钡离子 B、乙溶液中可能含有硫酸根离子 C、丙溶液中一定含有氯离子 D、丁溶液中一定含有钠离子14. 将一定量的锌粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,将滤渣放入稀盐酸溶液里,有气泡产生。则下列情况不可能存在的是( )A、滤渣是Ag、Cu、Zn B、滤液中含有Zn2+、Mg2+、 C、滤渣是Ag、Cu、Mg D、金属活动性顺序是Ag<Cu<Zn<Mg15. 通过海水晒盐的方法得到的仅仅是粗盐,其中还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在。为将这些杂质除净,可向食盐溶液中加过量的氢氧化钠溶液、碳酸钠溶液、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过滤、蒸发得到精盐。下列操作及加入溶液顺序错误的是( )A、Na2CO3、BaCl2、NaOH、过滤、HCl B、NaOH、BaCl2、Na2CO3、过滤、HCl C、BaCl2、Na2CO3、NaOH、过滤、HCl D、BaCl2、NaOH、Na2CO3、过滤、HCl二、填空题(每空2分,共40分)
-
16. “舌尖上的化学”。以下是厨房中一些实物图。

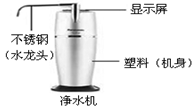 (1)、上述物质中牛肉富含营养物质。(2)、碘盐中的“碘”是指(选填“元素”、“原子”或“单质”)。(3)、净水机所标物质中属于有机合成材料的是 , 净水机中使用活性炭来除去水中一些溶解的杂质,是因为活性炭具有作用,生活中既能降低水的硬度,又能杀菌消毒的简单方法是。17. 请按要求从下列物质中A.CO B.NaHCO3 C.C2H5OH(酒精) D.CH4 E.CaO选择合适的物质,将其序号填写在下列横线上:
(1)、上述物质中牛肉富含营养物质。(2)、碘盐中的“碘”是指(选填“元素”、“原子”或“单质”)。(3)、净水机所标物质中属于有机合成材料的是 , 净水机中使用活性炭来除去水中一些溶解的杂质,是因为活性炭具有作用,生活中既能降低水的硬度,又能杀菌消毒的简单方法是。17. 请按要求从下列物质中A.CO B.NaHCO3 C.C2H5OH(酒精) D.CH4 E.CaO选择合适的物质,将其序号填写在下列横线上:①天然气的主要成分;②具有还原性的有毒气体;③碘酒的溶剂是; ④可用于治疗胃酸过多的是;⑤可作食品干燥剂的物质是;
18. 下图是常见实验仪器或装置。请回答下列问题:
 (1)、利用大理石和稀盐酸制取并收集CO2应选仪器(填序号)。(2)、实验室可用G装置制取O2 , 用H装置收集的O2。进行实验时,发现O2不纯,其原因除与水接触产生水蒸气外,另一原因可能(3)、测得用来收集氧气的集气瓶实际容积为300mL,要求收集的氧气占集气瓶容积的体积分数为50%(即空气占50%),可选用H装置收集。请简述实验操作方法:完成实验后,集气瓶中氧气的实际体积分数为(4)、下图为某同学的家庭实验,该装置左边部分发生反应的化学方程式是(醋酸化学式:CH3COOH) ;左边部分在操作上的优点是 , 该实验右边出现的现象是。
(1)、利用大理石和稀盐酸制取并收集CO2应选仪器(填序号)。(2)、实验室可用G装置制取O2 , 用H装置收集的O2。进行实验时,发现O2不纯,其原因除与水接触产生水蒸气外,另一原因可能(3)、测得用来收集氧气的集气瓶实际容积为300mL,要求收集的氧气占集气瓶容积的体积分数为50%(即空气占50%),可选用H装置收集。请简述实验操作方法:完成实验后,集气瓶中氧气的实际体积分数为(4)、下图为某同学的家庭实验,该装置左边部分发生反应的化学方程式是(醋酸化学式:CH3COOH) ;左边部分在操作上的优点是 , 该实验右边出现的现象是。 19. 有一包白色固体粉末,可能含有Na2SO4、BaCl2、NH4Cl、Na2CO3中的一种或几种。现做如下实验:
19. 有一包白色固体粉末,可能含有Na2SO4、BaCl2、NH4Cl、Na2CO3中的一种或几种。现做如下实验:
根据上述实验现象判断:
(1)、原白色固体中一定不含 , 一定含有。(2)、写出②中化学反应方程式。三、实验探究题(除21题第(3)小题6分外,其它每空3分,共45分)
-
20. 如图是教材中铁粉和硫磺反应的实验,取少量硫黄与铁粉混合,把混合物放进试管内,用酒精灯加热,当反应后扩展至整支试管时,立即停止加热,静置冷却后观察到生成了黑色固体。请简述证明铁粉和硫磺发生了化学反应的方法。此反应化学方程式是。

 21. 甲、乙两个实验小组分别进行“Na2CO3和NaCl混合物中Na2CO3含量测定”实验:
21. 甲、乙两个实验小组分别进行“Na2CO3和NaCl混合物中Na2CO3含量测定”实验: (1)、甲组的方法是:用已知浓度盐酸逐滴加到一定质量的混合物中,根据消耗盐酸溶液的体积来测定碳酸钠的含量.在实验过程中除盐酸、试样与水以外,判断反应是否恰好完全反应还须用到的试剂是(2)、乙组的方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,经换算并计算出样品中Na2CO3的质量.用右图装置测定产生CO2气体的体积,请分析图Ⅱ装置中油层的作用是
(1)、甲组的方法是:用已知浓度盐酸逐滴加到一定质量的混合物中,根据消耗盐酸溶液的体积来测定碳酸钠的含量.在实验过程中除盐酸、试样与水以外,判断反应是否恰好完全反应还须用到的试剂是(2)、乙组的方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,经换算并计算出样品中Na2CO3的质量.用右图装置测定产生CO2气体的体积,请分析图Ⅱ装置中油层的作用是使反应前后油层上方气体压强和外界大气压相同操作方法是 .
(3)、请你再设计一个与甲、乙组操作不同的实验方法,测定混合物中的Na2CO3含量.设计方法是22. 某课外小组的同学们收集了一含有CO和CO2的废气,为了确认这种废气的组成,他们在实验室按图1中装置进行了实验。
 (1)、B装置中盛放足量浓氢氧化钠溶液,其作用是。(2)、C装置中发生的化学方程式是。(3)、A装置和D装置完全相同,其作用的不同之处是。(4)、为了将氧化铁还原成铁,C、E点燃的顺序是 , 熄灭的顺序是(5)、该小组同学认为废气中的一氧化碳可以利用,于是设计如图2装置除去废气中的二氧化碳,并收集一瓶一氧化碳,准备进行后续的探究。其中最合理的装置是 , 瓶内盛放的液体是。
(1)、B装置中盛放足量浓氢氧化钠溶液,其作用是。(2)、C装置中发生的化学方程式是。(3)、A装置和D装置完全相同,其作用的不同之处是。(4)、为了将氧化铁还原成铁,C、E点燃的顺序是 , 熄灭的顺序是(5)、该小组同学认为废气中的一氧化碳可以利用,于是设计如图2装置除去废气中的二氧化碳,并收集一瓶一氧化碳,准备进行后续的探究。其中最合理的装置是 , 瓶内盛放的液体是。四、解答题(23题4分、24题6分,25题6分,26题10分、27题10分,28题13分,29题6分)
-
23. 请简述氢氧化钠固体为什么要密封保存并写出有关化学方程式。24. 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀。下图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀,以下为实验过程:
 (1)、 A试管中的反应开始时,打开止水夹,B试管中能看到的现象为。(2)、A试管中的反应进行足够长的时间后,若要在该装置中得到Fe(OH)2 , 并在一段时间内防止它被氧气氧化为Fe(OH)3 , 下一步的实验操作是。(3)、写出该装置中生成Fe(OH)2的化学方程式25. 某同学发现他家菜园中蔬菜生长迟缓,便施用了一种化肥硝酸铵。
(1)、 A试管中的反应开始时,打开止水夹,B试管中能看到的现象为。(2)、A试管中的反应进行足够长的时间后,若要在该装置中得到Fe(OH)2 , 并在一段时间内防止它被氧气氧化为Fe(OH)3 , 下一步的实验操作是。(3)、写出该装置中生成Fe(OH)2的化学方程式25. 某同学发现他家菜园中蔬菜生长迟缓,便施用了一种化肥硝酸铵。(硝酸铵)(NH4NO3)
硝酸铵含量>95%
净重:50Kg
含氮量:34.3%
(1)、硝酸铵属于 (选填“钾肥、磷肥、氮肥、复合肥”)(2)、多少克尿素(CO(NH2)2)与40克纯硝酸铵(NH4NO3)中含氮元素的质量相等?(3)、该化肥中硝酸铵的质量分数是多少?26. 在实验室,某同学将氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量。加入氢氧化钠溶液的质量(横轴)与混合溶液中溶质质量(纵轴)的关系如图所示。 (1)、实验中,观察到的现象为。(2)、实验中发生反应的化学方程式有。(3)、图中B→C段对应溶质质量减小的本质原因是。(4)、向反应后的溶液中加入适量BaCl2溶液,恰好完全反应后溶液中的溶质有。27. 普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如下图:
(1)、实验中,观察到的现象为。(2)、实验中发生反应的化学方程式有。(3)、图中B→C段对应溶质质量减小的本质原因是。(4)、向反应后的溶液中加入适量BaCl2溶液,恰好完全反应后溶液中的溶质有。27. 普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如下图:
求:
(1)、黄铜中Cu的质量分数。(2)、样品完全反应产生的H2的质量。(3)、稀盐酸的溶质质量分数。28. 现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3 + HCl = NaHCO3 + NaCl,然后才发生反应:NaHCO3+ HCl = NaCl + CO2↑+ H2O。

已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如右图。
(1)、当加入g盐酸时,才开始产生CO2;图中V=mL。(2)、请计算:①所加入盐酸中HCl的质量分数为多少?②原样品中Na2CO3和NaHCO3的质量各是多少?
29. 呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2),某化学兴趣小组的同学为了测定呼吸面具中过氧化钠的质量分数,在老师的指导下,利用如图所示装置(固定装置略去)开展探究.

已知,装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物.整套装置气密性良好,反应所需试剂均足量.
2Na2O2+2CO2═2Na2CO3+O2
相关实验数据如下:
Na2O2样品的质量/g
D反应前物质的质量/g
D反应后物质的质量/g
40g
222g
236g
(1)、装置E的作用为 .(2)、根据以上数据计算该样品的纯度.