浙江省宁波市鄞州区2020-2021学年九年级上学期科学第一次阶段性测试试卷(1-2章)
试卷更新日期:2020-11-05 类型:月考试卷
一、选择题(本题共15小题,第1~10小题每题4分,第11~15小题每题3分,共55分。请选出一个符合题意的选项,不选、多选、错选均不给分)
-
1. 下列有关化学方程式的书写正确的是( )A、2KClO3 KCl+O2 B、Al+H2SO4 = AlSO4+H2 C、Cu+2HCl═CuCl2+H2↑ D、Cu(OH)2+2HCl═CuCl2+2H2O2. 正确规范的操作是实验成功的关键,下列实验操作规范的是( )A、闻气味
 B、滴加液体
B、滴加液体  C、倾倒液体
C、倾倒液体  D、稀释浓硫酸
D、稀释浓硫酸  3. 铜能与硝酸反应,但不产生H2 . 根据反应方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2X↑+4H2O,推测X的化学式是( )A、N2O3 B、NO2 C、NO D、N2O4. 氢氧化钠的俗称是( )A、纯碱 B、烧碱 C、熟石灰 D、石灰石5. 已知某两种物质在一定条件下发生化学反应,其微观示意图如下,下列说法不正确的是( )
3. 铜能与硝酸反应,但不产生H2 . 根据反应方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2X↑+4H2O,推测X的化学式是( )A、N2O3 B、NO2 C、NO D、N2O4. 氢氧化钠的俗称是( )A、纯碱 B、烧碱 C、熟石灰 D、石灰石5. 已知某两种物质在一定条件下发生化学反应,其微观示意图如下,下列说法不正确的是( ) A、该反应中共有四种分子 B、该反应反应物中单质和化合物分子个数比是4:1 C、该反应符合质量守恒定律 D、该反应中反应物有单质和化合物6. 下列变化前后的数据关系不符合x>y的是( )A、一瓶稀硫酸溶液的pH=x , 将其加水稀释后溶液的pH=y B、一瓶浓盐酸的质量为x , 敞口放置一段时间后质量为y C、一瓶浓硫酸溶质的质量分数为x , 敞口放置一段时间后溶质质量分数为y D、酒精和水混合前的体积之和为x , 混合后总体积为y7. 通过观察和实验等方法,人们找到物质变化的证据。下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中实验现象对比最不明显的一组是( )A、
A、该反应中共有四种分子 B、该反应反应物中单质和化合物分子个数比是4:1 C、该反应符合质量守恒定律 D、该反应中反应物有单质和化合物6. 下列变化前后的数据关系不符合x>y的是( )A、一瓶稀硫酸溶液的pH=x , 将其加水稀释后溶液的pH=y B、一瓶浓盐酸的质量为x , 敞口放置一段时间后质量为y C、一瓶浓硫酸溶质的质量分数为x , 敞口放置一段时间后溶质质量分数为y D、酒精和水混合前的体积之和为x , 混合后总体积为y7. 通过观察和实验等方法,人们找到物质变化的证据。下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中实验现象对比最不明显的一组是( )A、 B、
B、 C、
C、 D、
D、 8. 酸奶中的乳酸(化学式为C3H6O3)对健康有益,有关乳酸的说法正确的是( )A、乳酸由碳、氢、氧三种原子构成 B、乳酸中氢元素的质量分数最小 C、乳酸属于氧化物 D、一个乳酸分子由碳、氢、氧三个元素组成9. 下图表示Fe、Zn、Mg、Al分别跟稀盐酸反应制取氢气的质量(m)与所用的金属质量(M)之间的关系图,其中正确的是( )A、
8. 酸奶中的乳酸(化学式为C3H6O3)对健康有益,有关乳酸的说法正确的是( )A、乳酸由碳、氢、氧三种原子构成 B、乳酸中氢元素的质量分数最小 C、乳酸属于氧化物 D、一个乳酸分子由碳、氢、氧三个元素组成9. 下图表示Fe、Zn、Mg、Al分别跟稀盐酸反应制取氢气的质量(m)与所用的金属质量(M)之间的关系图,其中正确的是( )A、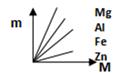 B、
B、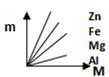 C、
C、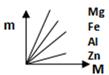 D、
D、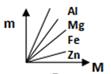 10. 下列物质在敞口容器中放置一段时间后(忽略水分蒸发),质量不会变化的是 ( )A、浓硫酸 B、浓盐酸 C、氯化钠固体 D、氢氧化钠固体11. 在化学反应A+B=C+D中,若有5克的A与10克的B恰好完全反应,生成1克的C和一定质量的D,,小明做实验前发现容器中只有5克B,则最多生成的D的质量为( )A、5克 B、7克 C、13克 D、8克12. 某校科学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
10. 下列物质在敞口容器中放置一段时间后(忽略水分蒸发),质量不会变化的是 ( )A、浓硫酸 B、浓盐酸 C、氯化钠固体 D、氢氧化钠固体11. 在化学反应A+B=C+D中,若有5克的A与10克的B恰好完全反应,生成1克的C和一定质量的D,,小明做实验前发现容器中只有5克B,则最多生成的D的质量为( )A、5克 B、7克 C、13克 D、8克12. 某校科学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( ) A、图中a点所示溶液中,含有的溶质是NaCl和NaOH B、由a点到b点的pH变化过程证明酸和碱发生了中和反应 C、向图中c点所示溶液中滴加无色酚酞,溶液不变色 D、该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中13. 在利用一定质量的双氧水和二氧化锰制取氧气的实验过程中,相关量的变化与时间的对应关系如图所示,则纵坐标可能表示( )
A、图中a点所示溶液中,含有的溶质是NaCl和NaOH B、由a点到b点的pH变化过程证明酸和碱发生了中和反应 C、向图中c点所示溶液中滴加无色酚酞,溶液不变色 D、该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中13. 在利用一定质量的双氧水和二氧化锰制取氧气的实验过程中,相关量的变化与时间的对应关系如图所示,则纵坐标可能表示( ) A、水的质量 B、氧气的质量 C、双氧水的质量 D、二氧化锰的质量14. 在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是( )
A、水的质量 B、氧气的质量 C、双氧水的质量 D、二氧化锰的质量14. 在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是( ) A、a=56% B、b=6% C、c=17% D、d=8%15. 甲、乙两烧杯内盛有等质量、等质量分数的盐酸.将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△M,画出△M﹣m曲线oac和obc的示意图,如图所示.根据图中信息,下列说法错误的是( )
A、a=56% B、b=6% C、c=17% D、d=8%15. 甲、乙两烧杯内盛有等质量、等质量分数的盐酸.将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△M,画出△M﹣m曲线oac和obc的示意图,如图所示.根据图中信息,下列说法错误的是( ) A、m1:m2=3:7 B、m1﹣△M1<m2﹣△M2 C、曲线oac表示的是甲烧杯中△M与m的变化关系 D、当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种
A、m1:m2=3:7 B、m1﹣△M1<m2﹣△M2 C、曲线oac表示的是甲烧杯中△M与m的变化关系 D、当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种二、填空题(本题共8小题,每空2分,共44分)
-
16. 选择Na、C、O、H、Fe五种元素的一种或几种,各写出一个化学式:酸;可溶性的碱难溶性碱。17. 硫酸和盐酸是实验室常用的试剂,也是重要的化工原料,它们既有相似之处,又有不同之点。
它们都能除铁锈,将带锈迹的铁钉放入过量的盐酸中,首先看到锈迹溶解,溶液呈色。不一会儿,又看到溶液中有气泡产生,这是因为(用化学方程式表示):。
18. 如图所示是某化学反应的微观粒子示意图。 (1)、该反应的基本类型属于 , 写出一个符合这一基本反应类型的化学方程式。(2)、根据化学反应的本质,生成物的方框内还应补充的粒子及数目是如图所示的 。A、一个
(1)、该反应的基本类型属于 , 写出一个符合这一基本反应类型的化学方程式。(2)、根据化学反应的本质,生成物的方框内还应补充的粒子及数目是如图所示的 。A、一个 B、两个
B、两个  C、一个
C、一个  D、两个
D、两个  19. 在一定条件下,Mg和MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
19. 在一定条件下,Mg和MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。 (1)、①氢气储存时发生反应的化学方程式为。
(1)、①氢气储存时发生反应的化学方程式为。②氢气很容易逃逸,若氢气存储效率为10%,储存1kg氢气,至少需要Mg的质量为kg.
(2)、①氢气释放时发生反应的化学方程式为。
②理论上,52kgMgH2最多能释放氢气的质量为kg.20. 下图表示的是一些物质在常温下的近似pH,回答下列问题: (1)、厨房清洁剂显性,在少量厨房清洁剂中滴入几滴酚酞,溶液呈;(2)、酸雨的酸性比正常雨水的酸性(填“强”或“弱”);(3)、测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使pH偏(“大”或“小”).21. 室温时,向滴加了无色酚酞的Ba(OH)2溶液的烧杯中逐滴加入稀硫酸,烧杯内溶液中溶质质量变化如图所示:
(1)、厨房清洁剂显性,在少量厨房清洁剂中滴入几滴酚酞,溶液呈;(2)、酸雨的酸性比正常雨水的酸性(填“强”或“弱”);(3)、测量苹果汁pH时,先用蒸馏水润湿pH试纸,会使pH偏(“大”或“小”).21. 室温时,向滴加了无色酚酞的Ba(OH)2溶液的烧杯中逐滴加入稀硫酸,烧杯内溶液中溶质质量变化如图所示: (1)、c点溶液中的溶质为。(不考虑酚酞)(2)、ob段实验的现象是。22. 某同学用稀硫酸在白纸上写了几个字,请你提供两种不同的方案将这些字显示出来。
(1)、c点溶液中的溶质为。(不考虑酚酞)(2)、ob段实验的现象是。22. 某同学用稀硫酸在白纸上写了几个字,请你提供两种不同的方案将这些字显示出来。方法一:,利用的原理是。
方法二:,利用的原理是。
23. 对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的化学性质后,初步归纳出稀硫酸与其他物质相互反应的关系,如图所示(“—”表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。 (1)、已知X是金属单质,则X可以是 (填一种即可)。(2)、请写出稀硫酸与Y反应的一个化学方程式:。
(1)、已知X是金属单质,则X可以是 (填一种即可)。(2)、请写出稀硫酸与Y反应的一个化学方程式:。三、实验探究题(本题共3小题,每空3分,共39分)
-
24. 在“质量守恒定律”的课堂教学中,老师引导同学们进行“化学反应中,反应物与生成物的质量关系”的实验探究。同学们按如图所示的实验装置,选用药品进行了规范的操作、准确的称量和细致的观察。

 (1)、甲乙两实验中发生了相同的化学反应(2HCl+Na2CO3=2NaCl+H2O+CO2↑),但化学反应结束后称量,发现甲实验中天平指针偏右,而乙实验中天平仍然平衡,分析其原因是。(2)、丙组同学完成镁带燃烧实验后发现镁带质量增加了,你认为镁带燃烧符合“质量守恒定律”吗?。(选填“符合”或“不符合”)25. 如图是实验室中用于制取和收集气体的装置图。
(1)、甲乙两实验中发生了相同的化学反应(2HCl+Na2CO3=2NaCl+H2O+CO2↑),但化学反应结束后称量,发现甲实验中天平指针偏右,而乙实验中天平仍然平衡,分析其原因是。(2)、丙组同学完成镁带燃烧实验后发现镁带质量增加了,你认为镁带燃烧符合“质量守恒定律”吗?。(选填“符合”或“不符合”)25. 如图是实验室中用于制取和收集气体的装置图。
请回答:
(1)、仪器①、②的名称分别是①;②。(2)、装置图中有一处明显的错误,请写出改正后的结果:。(3)、用氯酸钾制取氧气,应选用的发生装置是 (填字母),装入药品前必须进行的一步操作是 , 当用装置C收集满O2后,取出集气瓶,若要停止该实验下一步的正确操作是。(4)、实验室制取氢气(Zn+H2SO4=ZnSO4+H2↑),已知氢气不易溶于水,密度比空气小,应选用的反应装置是(填字母,下同),应选用的收集装置是。26. 小明发现二氧化锰催化过氧化氢分解的实验中,反应速度逐渐变慢,查阅资料得知:其原因是过氧化氢的溶质质量分数减小以及二氧化锰的催化能力降低,为了探究二氧化锰催化能力降低的影响因素,进行如下实验。【材料准备】取三份质量均为2g的二氧化锰分别催化40mL溶质质量分数为10%、20%、30%的过氧化氢溶液分解,实验后回收二氧化锰,并分别标为A、B、C;另取多次催化分解10%过氧化氢溶液后回收的二氧化锰,标为D。
【实验步骤】
①连接实验装置并检查气密性。

②取未使用过的二氧化锰0.5g,加入锥形瓶中,再加入10mL溶质质量分数为5%的过氧化氢溶液,记录收集120mL气体所需的时间。
③再分别取A、B、C、D四组二氧化锰各0.5g,重复上述实验。
④多次实验取平均值,记录数据见表:
组别
未使用过的二氧化锰
A
B
C
D
收集气体时间/s
17.9
23.2
27.7
32.3
37.8
(1)、实验时,长颈漏斗下端管口应在液面以下,其目的是。(2)、实验中,除通过比较收集相同体积气体所需的时间外,还可以通过比较来判断二氧化锰的催化能力。(3)、由表中数据可知,引起回收的二氧化锰催化能力下降的因素是。四、解答题(本题共7小题,第27、31、33题6分,28、29、30小题各4分,第32小题12分,共42分)
-
27. 在化学反应中,反应物分子间相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起化学反应。如图表示 HI 分子之间的几种碰撞示意图,有些 HI 分子碰撞后,会发生化学反应产生 H2 和 I2 , 有些碰撞不会发生反应。
 (1)、A、B、C三图中表示HI分子碰撞后发生了化学反应的是图。(2)、上述发生的反应属于化学基本反应类型中的反应。(3)、若要得到1个H2分子,至少需要个HI分子碰撞。28. 某学习小组在实验室中用加热KClO3和MnO2混合物的方法制取O2 , 反应过程中固体质量变化如图所示,请计算。
(1)、A、B、C三图中表示HI分子碰撞后发生了化学反应的是图。(2)、上述发生的反应属于化学基本反应类型中的反应。(3)、若要得到1个H2分子,至少需要个HI分子碰撞。28. 某学习小组在实验室中用加热KClO3和MnO2混合物的方法制取O2 , 反应过程中固体质量变化如图所示,请计算。 (1)、制取O2的质量是g。(2)、原混合物中KClO3的质量分数。(写出计算过程,计算结果精确到0.1%)29. 种新型“人造树叶”可吸收二氧化碳并转化为乙醇(C2H5OH)燃料,化学方程式为:
(1)、制取O2的质量是g。(2)、原混合物中KClO3的质量分数。(写出计算过程,计算结果精确到0.1%)29. 种新型“人造树叶”可吸收二氧化碳并转化为乙醇(C2H5OH)燃料,化学方程式为:2CO2+3H2O C2H5OH+3O2。研究显示,一升“人造树叶”每天可从空气中吸收968g CO2。
(1)、一升“人造树叶”工作一天可得到乙醇的质量是多少?(2)、若每天一棵树平均可吸收48.4g CO2 , 则一升“人造树叶”吸收的CO2相当于棵树吸收的CO2。30. 某化学兴趣小组为测定某大理石样品中碳酸钙的含量,将足量的稀盐酸加入到20 g大理石中(其它成分不与盐酸反应)充分反应,再将产生的CO2气体用足量的澄清石灰水吸收,同时测量2分钟内石灰水增加的质量,结果如下表所示:时间/s
0
20
40
60
80
100
120
石灰水增加的质量/g
0
3.0
5.0
6.0
6.6
6.6
6.6
(1)、共产生二氧化碳气体 g。(2)、计算大理石样品中碳酸钙的质量分数(写出计算过程)31. 实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5克,加入1克MnO2 , 完全反应后称得剩余物的质量为41.9克。计算:(1)、反应后MnO2的质量。(2)、反应中放出氧气的质量。(3)、实验中加入的过氧化氢溶液的质量分数。32. 为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴滴加某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图1所示.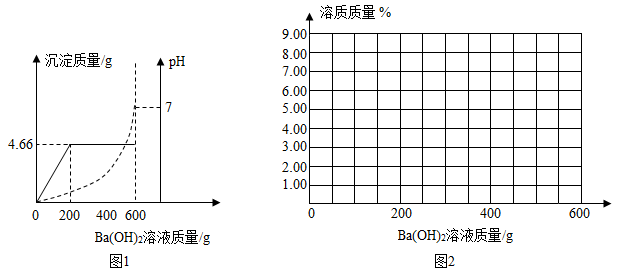
(1)、当加入的氢氧化钡溶液为g时,混合酸恰好被中和。(2)、求Ba(OH)2溶液中的溶质质量分数是多少?(写出计算过程,结果精确到0,01%)(3)、盐酸的溶质质量分数是 . (结果精确到0.01%)(4)、请在图2中画出向100g该混合酸中加入600g Ba(OH)2溶液的过程中,混合酸中溶质的质量与所加的Ba(OH)2溶液的质量关系图.33. 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据记录如下:
实验一
实验二
实验三
反应前稀盐酸+烧杯质量(克)
150
150
150
反应前固体样品质量(克)
4
8
12
反应后烧杯内物质+烧杯质量(克)
m
155.8
158.7
已知实验中发生的化学反应: NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)、分析表中数据,写出判断实验二中的样品已完全反应的理由:。(2)、表中的m值为。