天津市红桥区2019-2020学年九年级上学期化学期末考试试卷
试卷更新日期:2020-11-02 类型:期末考试
一、单选题
-
1. 下列行为符合“尊重自然,自觉践行绿色生活”理念的是( )A、“能开车就不步行”提高出行效率 B、燃放烟花爆竹,增强节日气氛 C、经常使用一次性筷子、塑料袋等 D、推广秸秆综合利用,杜绝露天焚烧2. 近段时间,猪肉价格的不断上涨对国民的生活带来了一定的影响。猪肉的新鲜度可以通过测试pH来判断。由表可知:新鲜肉在变质过程中酸性强弱的变化为( )
名称
新鲜肉
次鲜肉
变质肉
pH
5.8~6.2
6.3~6.6
>6.7
A、变强 B、变弱 C、不变 D、无法确定3. 铁遇稀硝酸可产生一种有毒气体X,其反应为Fe+4HNO3=Fe(NO3)3+X↑+2H2O,X的化学式为( )A、N2 B、NO C、N2O D、NO24. 下列图示的实验操作错误的是( )A、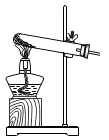 给固体加热
B、
给固体加热
B、 测溶液的pH
C、
测溶液的pH
C、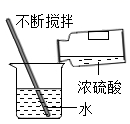 稀释浓硫酸
D、
稀释浓硫酸
D、 验满二氧化碳
5. 下列固体与水反应放热的是( )A、氢氧化钠 B、浓硫酸 C、生石灰 D、硝酸铵6. 把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出;若放入Mg(NO3)2溶液中,无明显现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是 ( )
验满二氧化碳
5. 下列固体与水反应放热的是( )A、氢氧化钠 B、浓硫酸 C、生石灰 D、硝酸铵6. 把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出;若放入Mg(NO3)2溶液中,无明显现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是 ( )
A、Mg、X、Cu B、X、Mg、Cu C、Mg、Cu、X D、Cu、X、Mg7. 下列灭火措施中不恰当的是( )①炒菜时,锅里的油起火应采取的最佳灭火措施是端下油锅
②桔秆、柴草着火,用水泼灭
③熄灭酒精灯最好用嘴吹灭
④电器着火,最先应当切断电源,再用干粉灭火器灭火
⑤汽油着火,应该立即用水浇灭
⑥撒在实验桌上的酒精着火,应用湿抹布盖灭.
A、①③⑤ B、②④⑥ C、①③⑥ D、②③⑤8. 对比是学习化学的重要方法,下列关于CO2与CO的叙述正确的是( )A、CO2和CO的化学性质相同 B、CO2和CO都能溶于水 C、CO2可用于光合作用,CO可用于人工降雨 D、CO2会造成温室效应,CO易与血液中的血红蛋白结合引起中毒9. 化学对科技发展具有重要作用,下列说法错误的是( )A、尖端技术采用液氮获得低温,利用了氮气的化学性质 B、用作新型电池电极材料的石墨烯与金刚石组成元素相同 C、中国具有自主知识产权的大飞机C919机身主体材料是铝合金 D、通过改变钢铁组成,表面覆盖保护层,可以确保港珠澳大桥使用寿命10. 如图表示对一杯氯化钠溶液进行恒温蒸发的过程,丙、丁溶液中析出部分氯化钠固体。下列说法错误的是( )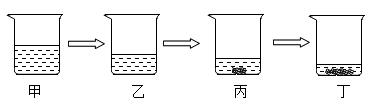 A、甲溶液一定是不饱和溶液 B、甲、乙两杯溶液中的溶质质量一定相等 C、整个实验过程中氯化钠的溶解度保持不变 D、烧杯中溶液的溶质质量分数大小关系为:丁>丙>乙>甲11. 下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是( )
A、甲溶液一定是不饱和溶液 B、甲、乙两杯溶液中的溶质质量一定相等 C、整个实验过程中氯化钠的溶解度保持不变 D、烧杯中溶液的溶质质量分数大小关系为:丁>丙>乙>甲11. 下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是( ) A、将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质 B、P点表示甲、丙两种物质的饱和溶液质量相等 C、t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4 D、t2℃时,甲、乙、丙三种物质的饱和溶液,降温t1℃至时所得溶液的溶质质量分数大小是乙>甲=丙12. 为探究锌、铜、铁三种金属的活动性顺序,某学习小组做了如图甲所示实验,实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,如图乙所示,则有( )
A、将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质 B、P点表示甲、丙两种物质的饱和溶液质量相等 C、t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4 D、t2℃时,甲、乙、丙三种物质的饱和溶液,降温t1℃至时所得溶液的溶质质量分数大小是乙>甲=丙12. 为探究锌、铜、铁三种金属的活动性顺序,某学习小组做了如图甲所示实验,实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,如图乙所示,则有( ) A、甲图试管①中反应后固体可能不含铁 B、甲图试管②中反应后固体可能含铁 C、反应后烧杯中的固体一定含有铁 D、烧杯中最后所得固体的质量一定大于2a g13. 类推是学习中常用的思维方法,现有以下类推结果,其中错误的是( )
A、甲图试管①中反应后固体可能不含铁 B、甲图试管②中反应后固体可能含铁 C、反应后烧杯中的固体一定含有铁 D、烧杯中最后所得固体的质量一定大于2a g13. 类推是学习中常用的思维方法,现有以下类推结果,其中错误的是( )①碱的水溶液通常呈碱性,所以碱性溶液一定是碱的溶液
②氧化物都含有氧元素,所以含氧元素的化合物不一定是氧化物
③酸碱发生中和反应生成盐和水,所以生成水的反应一定是中和反应
④燃烧一般都伴随发光、发热现象,所以有发光、发热现象的变化就是燃烧
⑤单质是由同种元素组成的,则由同种元素组成的纯净物一定是单质。
A、①②③④ B、①②③④⑤ C、②③④⑤ D、①③④14. 我国古代将赤铜(Cu2O)、炉甘石(ZnCO3)和木炭混合加热到800℃得到黄铜(铜锌合金)。若冶炼时所用Cu2O与ZnCO3的质量比为26:25,则所得黄铜的含铜量为( )A、67.5% B、51% C、65% D、64%二、多选题
-
15. 下列实验现象描述正确的是( )A、氢氧化钠固体放置于空气中:表面潮湿并逐渐溶解 B、硫在空气中燃烧:发出蓝紫色火焰,产生有刺激性气味的气体放热 C、石灰石和足量稀硫酸反应:固体逐渐减少至消失,表面有气泡产生 D、向少量的氧化铁中滴加足量的稀盐酸,红棕色粉未逐渐消失,溶液由无色变成黄色
三、填空题
-
16. 请从①一氧化碳;②活性炭;③盐酸;④氢气;⑤氦气;⑥氧气中,选取相应物质的序号填空(每种物质限选一次)。(1)、用于急救病人的气体是:;(2)、可用于冰箱除异味的是;(3)、极难发生化学反应的是;(4)、用于工业炼铁且有毒的气体是;(5)、最清洁的燃料是:;(6)、胃酸的主要成分是。17. 随着经济的发展,能源与环境成为人们日益关注的问题.(1)、煤、、常称为化石燃料.(2)、燃煤发电时,将煤块粉碎成煤粉,其目的是 .(3)、化石燃料燃烧都会产生二氧化碳,它是空气中含量最多的温室气体.为减少它的排放,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,转化为水和甲烷.该反应的化学方程式为 .(4)、“绿色化学”的特点之一是“零排放”.一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物.其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,这种产物是(填字母序号).
A 甲醇CH4O B 甲酸CH2O2 C 乙醇C2H6O D 乙酸C2H4O2
18. 写出下列变化涉及的化学方程式:(1)、酒精做燃料:;(2)、氢氧化铝中和胃酸:;(3)、二氧化碳使澄清石灰水变浑浊:。19. 图为A、B两种固体物质的溶解度曲线。 (1)、在t1℃时,A、B两种物质的溶解度。(2)、t1℃时,要使接近饱和的B物质溶液变为饱和溶液,可采取的一种措施是。(3)、t2℃时,A物质饱和溶液中溶质的质量分数为。若要把100克该饱和溶液稀释成质量分数为5%的溶液,应加水克。
(1)、在t1℃时,A、B两种物质的溶解度。(2)、t1℃时,要使接近饱和的B物质溶液变为饱和溶液,可采取的一种措施是。(3)、t2℃时,A物质饱和溶液中溶质的质量分数为。若要把100克该饱和溶液稀释成质量分数为5%的溶液,应加水克。四、简答题
-
20. 下面是某校学生进行“金属的物理性质和化学性质”的实验活动:
 (1)、将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则黄铜的硬度(填“>””<”或“=”)纯铜的硬度。(2)、同学收集到的金属制品有硬币、铝质导线、铜质火锅、小刀等,其中利用金属导热性的是。(3)、实验A中可观察到的现象为;实验B中,与酸反应最快。(4)、实验C中,小云同学选择一种金属丝放入两种不同溶液中,则所用的金属是;其中发生反应的化学方程式为 , 发生反应后该金属丝的质量(填“变大”“减小”或“不变”)
(1)、将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则黄铜的硬度(填“>””<”或“=”)纯铜的硬度。(2)、同学收集到的金属制品有硬币、铝质导线、铜质火锅、小刀等,其中利用金属导热性的是。(3)、实验A中可观察到的现象为;实验B中,与酸反应最快。(4)、实验C中,小云同学选择一种金属丝放入两种不同溶液中,则所用的金属是;其中发生反应的化学方程式为 , 发生反应后该金属丝的质量(填“变大”“减小”或“不变”)五、综合应用题
-
21. 金属材料广泛应用于生产生活中,某化学实验小组利用如图装置测定某赤铁矿中氧化铁的纯度。

向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应,回答下列问题:
(1)、实验过程中观察到装置A中玻璃管内发生的现象。(2)、写出A装置发生的化学反应方程式是;(3)、从环境保护的角度看该实验存在的缺陷是。(4)、实验前称量赤铁矿的质量为20g。通入足量的一氧化碳完全反应后B装置总质量增加了13.2g,则赤铁矿中氧化铁的纯度为。六、推断题
-
22. 构建知识框架是学习科学的重要方法,如图是初中科学金属的冶炼框架图(反应条件已省去)。已知甲、丁是最常见的固体金属,乙是常见的非金属固体,“→”表示反应的方向,请回答下列问题:
 (1)、单质乙是;(2)、“单质甲→单质丁”表示湿法炼铜,请写出其化学方程式;(3)、在冶炼金属丁的过程中,乙、丙的共同性质是。
(1)、单质乙是;(2)、“单质甲→单质丁”表示湿法炼铜,请写出其化学方程式;(3)、在冶炼金属丁的过程中,乙、丙的共同性质是。七、实验题
-
23. 某同学利用“多米诺骨牌效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色。请看图回答问题:
 (1)、写出指定仪器的名称:a。(2)、A中反应的化学方程式 , A装置的主要优点是 , MnO2的作用是;B中白磷不燃烧,原因是。(3)、C中看到的现象是。(4)、用化学方程式表示E中颜色变化的原因。(5)、F中的现象是 , 体现了该气体的物理性质是 , 化学性质是。24. 某同学配制50g 6%氢氧化钠溶液,整个操作过程如图1所示,回答下列问题:
(1)、写出指定仪器的名称:a。(2)、A中反应的化学方程式 , A装置的主要优点是 , MnO2的作用是;B中白磷不燃烧,原因是。(3)、C中看到的现象是。(4)、用化学方程式表示E中颜色变化的原因。(5)、F中的现象是 , 体现了该气体的物理性质是 , 化学性质是。24. 某同学配制50g 6%氢氧化钠溶液,整个操作过程如图1所示,回答下列问题: (1)、图①中盛放氢氧化钠固体的仪器名称是 , 需称取氢氧化钠g,配制时应选用mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水。(2)、经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是(填序号)。
(1)、图①中盛放氢氧化钠固体的仪器名称是 , 需称取氢氧化钠g,配制时应选用mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水。(2)、经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是(填序号)。A 氢氧化钠固体不纯
B 用生锈砝码称量
C 装瓶时有少量溶液洒出
D 溶解时烧杯内壁有水珠
(3)、欲测定此NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH(填“偏大”、“偏小”或“不受影响”)。(4)、室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度随加入盐酸质量而变化的曲线如图2所示。①B处溶液的溶质是(填化学式)
②在C点溶液中加入碳酸钙,反应的化学方程式为。
八、计算题
-
25. 减少SO2向大气的排放,工业上将生石灰跟煤均匀混合,煤燃烧时放出的SO2跟生石灰反应生成CaSO3 , CaSO3再被空气氧化成CaO4(石膏)而被“固化”。总反应方程式为:2CaO+2SO2+O2=2CaSO4 , 现某化工厂新进一批生石灰560t,其中含杂质20%(已知杂质不与二氧化硫反应),这批生石灰中含CaO吨,含钙吨,这批生石灰能吸收SO2吨。26. 实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
 (1)、a点溶液中含有的离子是。(2)、当pH=7时,消耗氢氧化钠溶液中NaOH质量为g。(3)、计算稀H2SO4中溶质的质量分数。(4)、计算恰好完全反应时所得溶液的溶质质量分数。
(1)、a点溶液中含有的离子是。(2)、当pH=7时,消耗氢氧化钠溶液中NaOH质量为g。(3)、计算稀H2SO4中溶质的质量分数。(4)、计算恰好完全反应时所得溶液的溶质质量分数。
-
-
-
-