北京市东城区2019-2020学年九年级上学期化学期末考试试卷
试卷更新日期:2020-11-02 类型:期末考试
一、单选题
-
1. 空气成分中,体积分数最大的是( )A、氮气 B、二氧化碳 C、氧气 D、稀有气体2. 下列符号表示2个氢分子的是( )A、H2 B、2H2O C、2H2 D、2H+3. 地壳中含量最多的元素是( )A、Si B、Al C、O D、Fe4. 下列操作错误的是( )A、
 加热液体
B、
加热液体
B、 滴加液体
C、
滴加液体
C、 测溶液pH
D、
测溶液pH
D、 过滤
5. 下列属于氧化物的是( )A、HNO3 B、MnO2 C、Cu(OH)2 D、CaCO36. 干冰的成分是( )A、CO B、CO2 C、H2CO3 D、H2O7. 下列物质与水混合不能形成溶液的是( )A、蔗糖 B、酒精 C、食盐 D、植物油8. 下列物质的化学式书写错误的是( )A、氯化锌 ZnCl B、硫酸钙 CaSO4 C、氢氧化钾 KOH D、氧化镁 MgO9. 下列食物显碱性的是( )
过滤
5. 下列属于氧化物的是( )A、HNO3 B、MnO2 C、Cu(OH)2 D、CaCO36. 干冰的成分是( )A、CO B、CO2 C、H2CO3 D、H2O7. 下列物质与水混合不能形成溶液的是( )A、蔗糖 B、酒精 C、食盐 D、植物油8. 下列物质的化学式书写错误的是( )A、氯化锌 ZnCl B、硫酸钙 CaSO4 C、氢氧化钾 KOH D、氧化镁 MgO9. 下列食物显碱性的是( )食物
苹果汁
葡萄汁
牛奶
鸡蛋清
pH
2.9~3.3
3.5~4.5
6.3~6.6
7.6~8.0
A、苹果汁 B、葡萄汁 C、牛奶 D、鸡蛋清10. 能闻到花香,说明分子的性质是( )A、分子的体积很小 B、分子的质量很小 C、分子在不断运动 D、分子之间有间隔11. 下列实验现象错误的是( )选项
A
B
C
D
实验




实验现象
剧烈燃烧,火星四射,放出大量的热,生成黑色固体
出现白色浑浊
溶液由无色变为红色
产生气泡,溶液变为浅绿色
A、A B、B C、C D、D12. 用灯帽盖灭酒精灯的灭火原理是( )A、清除可燃物 B、降低酒精的着火点 C、隔绝空气 D、降低温度至酒精的着火点以下13. 下列我国科技成果所涉及物质的应用中,体现物质物理性质的是( )



A 利用石墨烯优异的导电性,制成新型电阻触摸屏的电极
B可燃冰是天然气水合物,作为新能源使用
C 甲醇(CH3OH)低温制得氢气,用于新能源汽车
D 优化煤的综合利用,发展煤制乙醇(C2H5OH)技术
A、A B、B C、C D、D14. 2019年是元素周期表诞生150周年。下图为铝元素在元素周期表中的部分信息。下列说法错误的是( ) A、铝属于非金属元素 B、铝的原子序数为13 C、铝原子核外电子数是13 D、铝的相对原子质量是26.9815. 配制50g质量分数为20%的NaCl溶液。下列有关操作正确的是( )A、
A、铝属于非金属元素 B、铝的原子序数为13 C、铝原子核外电子数是13 D、铝的相对原子质量是26.9815. 配制50g质量分数为20%的NaCl溶液。下列有关操作正确的是( )A、 取固体
B、
取固体
B、 称固体
C、
称固体
C、 量取水
D、
量取水
D、 溶解
16. 下列物质的用途错误的是( )A、食盐作调味品 B、金属铜作导线 C、烧碱用于改良酸性土壤 D、干冰用于人工降雨17. 利用氢氟酸(HF)蚀刻玻璃,发生的化学方程式为:SiO2 +4HF =X↑+2H2O,物质X为( )A、SiO B、SiF4 C、SiF D、F218. 碳酸乙烯酯(C3H4O3)可用作锂电池电解液。下列有关碳酸乙烯酯的说法错误的是( )A、由碳、氢和氧三种元素组成 B、其中碳元素的质量分数最大 C、其中氢元素与氧元素的质量比为1:12 D、每个碳酸乙烯酯分子中含有10个原子19. 如图所示装置可用于测定空气中氧气的含量。下列说法错误的是( )
溶解
16. 下列物质的用途错误的是( )A、食盐作调味品 B、金属铜作导线 C、烧碱用于改良酸性土壤 D、干冰用于人工降雨17. 利用氢氟酸(HF)蚀刻玻璃,发生的化学方程式为:SiO2 +4HF =X↑+2H2O,物质X为( )A、SiO B、SiF4 C、SiF D、F218. 碳酸乙烯酯(C3H4O3)可用作锂电池电解液。下列有关碳酸乙烯酯的说法错误的是( )A、由碳、氢和氧三种元素组成 B、其中碳元素的质量分数最大 C、其中氢元素与氧元素的质量比为1:12 D、每个碳酸乙烯酯分子中含有10个原子19. 如图所示装置可用于测定空气中氧气的含量。下列说法错误的是( ) A、实验前一定要检查装置的气密性 B、红磷足量是实验成功的关键之一 C、打开弹簧夹,集气瓶液面上升至1处,可说明氧气约占空气体积的1/5 D、该实验所用的红磷可用木炭代替20. 某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分,反应的微观示意图如下。下列说法正确的是( )
A、实验前一定要检查装置的气密性 B、红磷足量是实验成功的关键之一 C、打开弹簧夹,集气瓶液面上升至1处,可说明氧气约占空气体积的1/5 D、该实验所用的红磷可用木炭代替20. 某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分,反应的微观示意图如下。下列说法正确的是( ) A、四种物质均属于化合物 B、物质丁由原子构成 C、参加反应的甲与生成的丁的分子个数比为2:1 D、参加反应的甲与乙的质量比为1:221. 利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法错误的是( )
A、四种物质均属于化合物 B、物质丁由原子构成 C、参加反应的甲与生成的丁的分子个数比为2:1 D、参加反应的甲与乙的质量比为1:221. 利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法错误的是( ) A、先推入的是NaOH溶液 B、BC段,CO2与NaOH反应基本停止 C、D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多 D、最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
A、先推入的是NaOH溶液 B、BC段,CO2与NaOH反应基本停止 C、D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多 D、最终压强比初始压强小,可能是因为有部分二氧化碳溶于水二、选择题组
-
22. 依据实验和溶解度曲线回答以下小题:
20℃时,向下列5只盛有100g水的烧杯中,分别加入不同质量的固体,充分溶解。

 (1)、上述溶液为饱和溶液的是( )A、①②④ B、①③⑤ C、②③⑤ D、③④⑤(2)、④中溶液的质量为( )A、80g B、100g C、180g D、190g(3)、下列温度中,KNO3比NaNO3溶解度大的是( )A、30℃ B、50℃ C、60℃ D、90℃
(1)、上述溶液为饱和溶液的是( )A、①②④ B、①③⑤ C、②③⑤ D、③④⑤(2)、④中溶液的质量为( )A、80g B、100g C、180g D、190g(3)、下列温度中,KNO3比NaNO3溶解度大的是( )A、30℃ B、50℃ C、60℃ D、90℃三、填空题
-
23. 垃圾分类利国利民。请将垃圾正确分类,一一对应,补齐连线。
 24. 空气和水都是人类的宝贵资源。(1)、洁净的空气属于(填“混合物”或“纯净物”)。(2)、人类的生命活动离不开空气,因为空气中的氧气能起到的作用。(3)、海水淡化可缓解淡水资源匮乏的问题。如图为太阳能海水淡化装置示意图。从微观的角度分析,海水中的水变成水蒸气的过程中,没有改变的是 , 变化的是。
24. 空气和水都是人类的宝贵资源。(1)、洁净的空气属于(填“混合物”或“纯净物”)。(2)、人类的生命活动离不开空气,因为空气中的氧气能起到的作用。(3)、海水淡化可缓解淡水资源匮乏的问题。如图为太阳能海水淡化装置示意图。从微观的角度分析,海水中的水变成水蒸气的过程中,没有改变的是 , 变化的是。 25. 家庭自制汽水时,需加入白糖、食用色素、小苏打、柠檬酸、凉开水等。(1)、汽水是溶液,其中加入的白糖是(填“溶质”或“溶剂”)。(2)、饮用汽水时,将瓶盖打开,会有大量气泡冒出,该气体的成分是 , 将该气体通入澄清石灰水中,观察到 , 反应的化学方程式为。26. 小寒是二十四节气之一。下面列举了一些民间小寒风俗食物。
25. 家庭自制汽水时,需加入白糖、食用色素、小苏打、柠檬酸、凉开水等。(1)、汽水是溶液,其中加入的白糖是(填“溶质”或“溶剂”)。(2)、饮用汽水时,将瓶盖打开,会有大量气泡冒出,该气体的成分是 , 将该气体通入澄清石灰水中,观察到 , 反应的化学方程式为。26. 小寒是二十四节气之一。下面列举了一些民间小寒风俗食物。 (1)、高钙羊肉中的钙是指钙(填“分子”、“原子”或“元素”);中老年人多吃含钙的食物能够预防(填“骨质疏松”或“贫血”)。(2)、从营养均衡角度考虑,合理的食物搭配是(填字母序号)。
(1)、高钙羊肉中的钙是指钙(填“分子”、“原子”或“元素”);中老年人多吃含钙的食物能够预防(填“骨质疏松”或“贫血”)。(2)、从营养均衡角度考虑,合理的食物搭配是(填字母序号)。A ①②③ B ③④⑤ C ①③⑤
27. 人类的生产生活离不开燃料。(1)、化石燃料包括天然气、煤和 , 天然气的主要成分是。(2)、家用燃气热水器的工作原理如图1所示,若“空气进气孔”被部分堵塞,导致天然气燃烧不充分,会产生的有毒气体是。 (3)、氢气属于清洁燃料,是因为。工业上利用氢氧焰(氢气在氧气中燃烧所产生的高温火焰)切割金属。进行图2所示实验:关闭K,点燃氢气(已验纯),铁丝发红,不熔断;打开K,一段时间后,点燃氢气(已验纯),铁丝熔断。出现上述不同现象的原因是。28. 金属与我们生活息息相关。(1)、放置在空气中的铝制品表面会形成一层致密的氧化膜,该氧化膜的成分是。(2)、铸造硬币不需要考虑金属的(填字母序号)。
(3)、氢气属于清洁燃料,是因为。工业上利用氢氧焰(氢气在氧气中燃烧所产生的高温火焰)切割金属。进行图2所示实验:关闭K,点燃氢气(已验纯),铁丝发红,不熔断;打开K,一段时间后,点燃氢气(已验纯),铁丝熔断。出现上述不同现象的原因是。28. 金属与我们生活息息相关。(1)、放置在空气中的铝制品表面会形成一层致密的氧化膜,该氧化膜的成分是。(2)、铸造硬币不需要考虑金属的(填字母序号)。A 硬度 B 抗腐蚀性 C 导电性
(3)、用除锈剂(有效成分为稀盐酸)除铁锈反应的化学方程式为。29. 我国科学家研发出由二氧化碳高效转化为甲醇(CH3OH)的新技术。(1)、二氧化碳转化为甲醇的化学方程式为:CO2 + 3H2 CH3OH + H2O。若22gCO2完全反应,理论上可得到CH3OH的质量为g。(2)、该技术可能解决的环境问题是(填一条即可)。(3)、甲醇在空气中充分燃烧生成二氧化碳和水,反应的化学方程式为 。四、科普阅读题
-
30. 阅读下面科普短文。
蓝黑墨水斑是档案上常出现的污斑之一,去除档案上的污斑是档案修复工作中的一个重要环节。
蓝黑墨水斑用水或有机溶剂难以去除,在修复档案时,多采用氧化方法进行处理,利用氧化性较强的化学药品对污斑色素进行氧化,强行破坏有机色素的发色团,使之变为无色,从而使蓝黑墨水斑得以去除。修复部门可用84消毒液(有效成分为NaClO)对宣纸上的蓝黑墨水斑进行清洗。
科研人员用宣纸制作了蓝黑墨水污斑模拟样品纸张,将污斑部位浸入40mL、一定浓度(体积百分比浓度)的84消毒液中,一段时间后取出,用40 mL的去离子水清洗2次,于阴凉处晾干。测定污斑样品纸张清洗前后色差值以确定去除污斑效果。清洗效果与色差值如表1所示:
表1 清洗效果与色差值
清洗前
清洗后①
清洗后②
清洗后③
清洗后④
清洗效果图





色差值
8.58
22.93
40.70
60.00
科研人员完成了一系列实验,用所得数据绘制如下曲线:

84消毒液作为一种氧化性能适中的溶液,即使低浓度溶液同样具有较好的去除污斑效果,且反应速率较快,作用时间较短。蓝黑墨水斑经低浓度的84消毒液氧化去污后再经2次水洗,基本检测不出氧化剂残留,短期内对纸张性能的影响较小。过高浓度的84消毒液可能对纸张造成破坏,加速纸张性能的下降。
依据文章内容回答下列问题。
(1)、利用氧化法去除蓝黑墨水污斑是(填“物理”或“化学”)变化。(2)、84消毒液有效成分为NaClO,NaClO中氯元素质量分数的计算式为。(3)、分析表1,可以得到清洗效果与色差值之间的关系为。(4)、由图1可知,去除蓝黑墨水污斑效果与84消毒液浓度的关系是。(5)、下列说法正确的是(填字母序号)。A 高浓度的84消毒液可能对纸张造成破坏
B 用84消毒液浸泡后,应进行水洗
C 60℃时,用0.5%的84消毒液浸泡5 min后,没有达到好的清洗效果
五、流程题
-
31. 过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,可以由鸡蛋壳(含CaCO3高达90%)为原料制得,其制备流程如下:
 (1)、反应1为高温煅烧碳酸钙,其化学方程式为。(2)、反应2的化学方程式为:CaO + H2O2 + 7H2O CaO2·8H2O,该反应属于化合反应。CaO2·8H2O属于(填字母序号)。
(1)、反应1为高温煅烧碳酸钙,其化学方程式为。(2)、反应2的化学方程式为:CaO + H2O2 + 7H2O CaO2·8H2O,该反应属于化合反应。CaO2·8H2O属于(填字母序号)。A 混合物 B 纯净物 C 化合物
(3)、反应2制得的CaO2·8H2O中,可能含有的固体杂质是(填化学式)。32. NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺流程如下: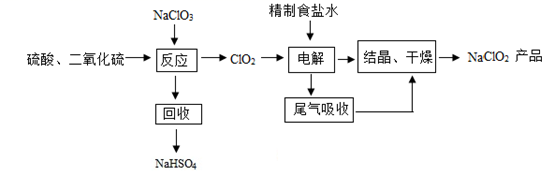 (1)、NaClO2中Cl的化合价为。(2)、补全化学方程式:2NaClO3++=2ClO2+2NaHSO4。(3)、精制食盐水时,用NaOH溶液将杂质MgCl2转化为沉淀除去,该复分解反应的化学方程式为。(4)、该工艺流程中体现环保意识的环节是(填写一条即可)。
(1)、NaClO2中Cl的化合价为。(2)、补全化学方程式:2NaClO3++=2ClO2+2NaHSO4。(3)、精制食盐水时,用NaOH溶液将杂质MgCl2转化为沉淀除去,该复分解反应的化学方程式为。(4)、该工艺流程中体现环保意识的环节是(填写一条即可)。六、实验题
-
33. 用如图装置进行氧气的制取和性质实验。
 (1)、A中反应的化学方程式为。(2)、用B收集氧气,依据氧气的性质是。(3)、收集满氧气后,将蜡烛C放入B中,观察到的现象是。34. 用如图装置验证可燃物的燃烧条件。
(1)、A中反应的化学方程式为。(2)、用B收集氧气,依据氧气的性质是。(3)、收集满氧气后,将蜡烛C放入B中,观察到的现象是。34. 用如图装置验证可燃物的燃烧条件。
(已知:白磷的着火点为40℃,红磷的着火点为240℃)
(1)、铜片上白磷燃烧,红磷不燃烧,可得出的结论是。(2)、通过现象,能够验证可燃物燃烧需要与氧气接触。(3)、使水中白磷燃烧,可进行的操作是。35. 根据下图所示的实验回答问题。 (1)、甲中棉花的作用是。(2)、乙的目的是研究品红分子在水中的运动速率与的关系。(3)、丙是电解水实验,反应的化学方程式为;与电源正极相连的试管中产生的气体是。(4)、丁是验证质量守恒定律。其中红磷燃烧的化学方程式为;充分反应并冷却后,天平仍保持平衡,从微观的角度解释其原因:。36. 为了验证Fe、Cu、Ag的金属活动性顺序,设计如下实验。
(1)、甲中棉花的作用是。(2)、乙的目的是研究品红分子在水中的运动速率与的关系。(3)、丙是电解水实验,反应的化学方程式为;与电源正极相连的试管中产生的气体是。(4)、丁是验证质量守恒定律。其中红磷燃烧的化学方程式为;充分反应并冷却后,天平仍保持平衡,从微观的角度解释其原因:。36. 为了验证Fe、Cu、Ag的金属活动性顺序,设计如下实验。 (1)、实验①的化学方程式为 , 得到的结论是。(2)、为了达到实验目的,X溶液可以是(填一种即可),对应的实验现象是。37. 利用下图实验装置模拟工业炼铁。
(1)、实验①的化学方程式为 , 得到的结论是。(2)、为了达到实验目的,X溶液可以是(填一种即可),对应的实验现象是。37. 利用下图实验装置模拟工业炼铁。 (1)、一氧化碳还原氧化铁的化学方程式为。(2)、a处能观察到的现象是 , 澄清石灰水的作用是。38. 用下图所示操作进行酸碱中和反应的实验,回答问题。
(1)、一氧化碳还原氧化铁的化学方程式为。(2)、a处能观察到的现象是 , 澄清石灰水的作用是。38. 用下图所示操作进行酸碱中和反应的实验,回答问题。 (1)、A是稀释浓硫酸的操作,物质甲应为。(2)、向E中加入一定量的稀硫酸后,得到无色溶液,说明氢氧化钠溶液与稀硫酸发生反应,该反应的化学方程式为。若上述现不能说明恰好完全反应,理由是。
(1)、A是稀释浓硫酸的操作,物质甲应为。(2)、向E中加入一定量的稀硫酸后,得到无色溶液,说明氢氧化钠溶液与稀硫酸发生反应,该反应的化学方程式为。若上述现不能说明恰好完全反应,理由是。七、科学探究题
-
39. 化学小组用图1装置验证二氧化碳与水的反应。

盐酸浓度
观察到的现象
甲组
浓盐酸(36.5%)
B中石蕊溶液由紫色变成红色
C中石蕊溶液没有变为紫色
乙组
稀盐酸(13.5%)
B中石蕊溶液由紫色变为红色
C中石蕊溶液变为紫色
(1)、A中反应的化学方程式为。(2)、乙组C中反应的化学方程式为。(讨论与交流)同学们认为甲组C中石蕊溶液没有变为紫色,是因为浓盐酸挥发出过多的HCl溶于石蕊溶液。
(提出猜想)盐酸的挥发性与浓度有关。
(进行实验)用图2装置研究不同浓度盐酸的挥发性。用离子传感器测定烧杯中所得溶液的氯离子浓度(氯离子浓度可以近似表示挥发出的HCl的量),实验数据见下表。

盐酸浓度与氯离子浓度的对应关系(相同时间内测得)
盐酸浓度(%)
13.5
20
26.2
29.2
32.2
36.5
氯离子浓度(mg/L)
1.1
1.4
3.7
19.0
59.8
209.2
分析表中数据 , 能够得出盐酸的挥发性与浓度的关系是。
(得出结论)猜想正确
(实验反思)甲组石蕊溶液变红不能证明二氧化碳与水反应。
(实验改进)甲组同学在装置A与装置B之间连接装置D。三个装置之间导管口的连接顺序是:a→ →→b。选择饱和NaHCO3溶液除杂的原因是。

-
-