浙江省宁波市海曙区2020-2021学年九年级上学期科学第一次质量检测试卷
试卷更新日期:2020-11-02 类型:月考试卷
一、选择题(本题共15小题,第1~10小题,每小题4分,第11~15小题,每小题3分,共55分。请选出每小题中符合题意的选项,不选、错选均不给分)
-
1. 对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是( )A、
 B、
B、 C、
C、 D、
D、 2. 人体吸入的 O2 有 2%转化为活性氧,它加速人体衰老,被称为“夺命杀手”。我国科学家尝试用 Na2SeO3 清除人体内的活性氧,Na2SeO3 中 Se(硒)元素的化合价是( )A、+2 B、+6 C、+4 D、-23. 一些实物的近似pH值如下表,对于胃酸过多的人,空腹时最宜食用的是( )
2. 人体吸入的 O2 有 2%转化为活性氧,它加速人体衰老,被称为“夺命杀手”。我国科学家尝试用 Na2SeO3 清除人体内的活性氧,Na2SeO3 中 Se(硒)元素的化合价是( )A、+2 B、+6 C、+4 D、-23. 一些实物的近似pH值如下表,对于胃酸过多的人,空腹时最宜食用的是( )食物 苹果 柑桔 牛奶 鸡蛋清 pH 2.9~3.3 5.0~5.7 6.3~6.6 7.6~8.0 A、苹果 B、柑桔 C、牛奶 D、鸡蛋清4. 下列物质的性质属于物理性质的是( )A、浓盐酸的挥发性 B、浓硫酸的脱水性 C、硝酸的氧化性 D、碳酸的不稳定性5. 下列实验数据合理的是( )①用托盘天平称取15.6g氧化铜粉末 ②用广泛pH试纸测得溶液的pH为3.52
③用100mL量筒量取5.26mL的稀硫酸 ④用普通温度计测得某液体的温度为25.62℃
⑤用10mL量筒量取某溶液6.6mL
A、①② B、②③④ C、④⑤ D、①⑤6. 能区别稀硫酸、水和烧碱三种液体的试剂是( )A、锌粒 B、无色酚酞试液 C、氯化钡溶液 D、紫色石蕊试液7. 能用溶解、过滤、蒸发、结晶分离的一组混合物是( )A、酒精和水 B、氯化钠和碳酸钠 C、碳酸钙和二氧化锰 D、碳酸钙和氯化钠8. A、B、C三种物质各15克,它们化合时只能生成30克新物质D。若增加10克A,则反应停止后,原反应物中只剩余C。根据上述条件推断下列说法中正确的是( )A、第一次反应停止后,B剩余9克 B、第二次反应后,D的质量为50克 C、反应中A和B的质量比是3:2 D、反应中A和C的质量比是5:39. 如图是实验室制备、收集、验满、验证性质的操作,其中正确的是( )A、制备 B、收集
B、收集  C、
C、 验满
D、验证性质
验满
D、验证性质  10. 如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好。现往试管中加入下列某种物质,红墨水不会移动的是( )
10. 如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好。现往试管中加入下列某种物质,红墨水不会移动的是( ) A、NaOH固体 B、蔗糖 C、浓H2SO4 D、生石灰11. 某校科学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A、NaOH固体 B、蔗糖 C、浓H2SO4 D、生石灰11. 某校科学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( ) A、图中a点所示溶液中,含有的溶质是NaCl和NaOH B、由a点到b点的pH变化过程证明酸和碱发生了中和反应 C、向图中c点所示溶液中滴加无色酚酞,溶液不变色 D、该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中12. 往一定量的稀硫酸中加入过量的锌粒,如图所示是反应过程中某种量y随加入锌粒的质量变化的图像。由此可知,y不可能表示( )
A、图中a点所示溶液中,含有的溶质是NaCl和NaOH B、由a点到b点的pH变化过程证明酸和碱发生了中和反应 C、向图中c点所示溶液中滴加无色酚酞,溶液不变色 D、该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中12. 往一定量的稀硫酸中加入过量的锌粒,如图所示是反应过程中某种量y随加入锌粒的质量变化的图像。由此可知,y不可能表示( ) A、溶液中水的质量 B、生成硫酸锌的质量 C、参加反应的硫酸质量 D、生成氢气的质量13. 在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持一起已略去),引起同学们的兴趣,如图是四位同学对实验中的部分现象的预测,预测正确的是( )
A、溶液中水的质量 B、生成硫酸锌的质量 C、参加反应的硫酸质量 D、生成氢气的质量13. 在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持一起已略去),引起同学们的兴趣,如图是四位同学对实验中的部分现象的预测,预测正确的是( )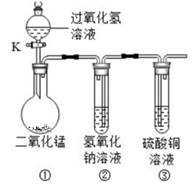 A、打开活塞K,装置①中会有气泡冒出,黑色固体消失 B、打开活塞K,装置②中会看到液面上升,产生蓝色沉淀 C、打开活塞K,装置②中会有气泡冒出 D、打开活塞K,装置③中会有液体流入,产生蓝色沉淀14. 利用数字化实验可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,瓶内气压的变化如曲线所示。有关说法正确的是( )
A、打开活塞K,装置①中会有气泡冒出,黑色固体消失 B、打开活塞K,装置②中会看到液面上升,产生蓝色沉淀 C、打开活塞K,装置②中会有气泡冒出 D、打开活塞K,装置③中会有液体流入,产生蓝色沉淀14. 利用数字化实验可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,瓶内气压的变化如曲线所示。有关说法正确的是( ) A、曲线①表示块状碳酸钙与稀盐酸反应 B、b点表示碳酸钙与盐酸反应已停止 C、等质量碳酸钙粉末产生的CO2的质量较多 D、对比分析点c、d可知,相同的气压时,粉末碳酸钙与稀盐酸反应速率更快15. 现有一份氧元素质量分数为90%的过氧化氢溶液,加入MnO2充分反应,得到液体的质量为90g(不考虑操作过程中液体的损失),则生成氧气的质量是( )A、4.8 B、5.2g C、10g D、10.8g
A、曲线①表示块状碳酸钙与稀盐酸反应 B、b点表示碳酸钙与盐酸反应已停止 C、等质量碳酸钙粉末产生的CO2的质量较多 D、对比分析点c、d可知,相同的气压时,粉末碳酸钙与稀盐酸反应速率更快15. 现有一份氧元素质量分数为90%的过氧化氢溶液,加入MnO2充分反应,得到液体的质量为90g(不考虑操作过程中液体的损失),则生成氧气的质量是( )A、4.8 B、5.2g C、10g D、10.8g二、填空题(本题共6小题,每空2分,共36分)
-
16. 如表是几种家用清洁剂的功效和有效成分。

根据表中信息,回答下列问题。
(1)、三种清洁剂的有效成分中,属于氧化物的是(填化学式)(2)、大理石上的污垢不能用“洁厕灵”清洁的理由是17. 右图是某学生设计的一种有洗气、检验、贮气等用途的装置。 (1)、当除去氧气中混有的水蒸气时,混合气体应从(填A或B)处导管进入,瓶中盛有的物质可以是(2)、当检验实验室制取的氢气是否含有氯化氢时,瓶中盛有的试剂可以是(3)、当用排水集气法收集一氧化碳时,瓶内先装满水,气体从(填A或B,下同)处导管通入。若要用水将瓶中一氧化碳排出使用,水应从处导管进入。18. 结合NaOH、Ca(OH)2的相关知识,回答下列问题(1)、可用来改变酸性土壤的固体是;(2)、从微观角度看,它们的溶液具有相似化学性质的原因是;(3)、除去NaOH溶液中混有的少量Ca(OH)2 , 可选用的试剂是 .19.
(1)、当除去氧气中混有的水蒸气时,混合气体应从(填A或B)处导管进入,瓶中盛有的物质可以是(2)、当检验实验室制取的氢气是否含有氯化氢时,瓶中盛有的试剂可以是(3)、当用排水集气法收集一氧化碳时,瓶内先装满水,气体从(填A或B,下同)处导管通入。若要用水将瓶中一氧化碳排出使用,水应从处导管进入。18. 结合NaOH、Ca(OH)2的相关知识,回答下列问题(1)、可用来改变酸性土壤的固体是;(2)、从微观角度看,它们的溶液具有相似化学性质的原因是;(3)、除去NaOH溶液中混有的少量Ca(OH)2 , 可选用的试剂是 .19.敞口放置的氢氧化钠溶液易变质,请写出此过程的化学方程式:。现向一定质量且部分变质的氢氧化钠溶液中滴加入稀盐酸,并振荡。(如下图)表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。那么,图线BC段对应的实验现象是 , 在C点时溶液中的溶质是。
 20. 右图是实验室制氧气的部分装置图。请据图回答:
20. 右图是实验室制氧气的部分装置图。请据图回答: (1)、实验室用双氧水制取氧气,应从图一种选择装置作为发生装置(用字母表示)(2)、某同学用A装置制取氧气时发现试管固定得太高,该同学应调节图二中的旋钮(填“①”或“②”或“③”)。21. 质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题:(1)、化学反应前后肯定没有变化的是 __________(填字母序号)。
(1)、实验室用双氧水制取氧气,应从图一种选择装置作为发生装置(用字母表示)(2)、某同学用A装置制取氧气时发现试管固定得太高,该同学应调节图二中的旋钮(填“①”或“②”或“③”)。21. 质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题:(1)、化学反应前后肯定没有变化的是 __________(填字母序号)。①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类
⑥参加反应的物质的总质量和生成物的总质量
A、①④⑥ B、①③⑤⑥ C、①②⑥ D、②③⑤(2)、镁条在纯氧中完全燃烧后生成氧化镁,燃烧现象如图乙。若固体质量变化用图甲表示,则m2-m1表示的质量(3)、若用足量镁粉进行如图丙(粗测空气中氧气体积分数)所示实验,实验结果明显偏大,请说出最主要原因。
三、实验探究题(本题共3小题,每空3分,共39分)
-
22. 如图所示,一个倒置的大烧杯内放置甲、乙两个小烧杯。甲杯中盛有浓盐酸,乙杯中盛有紫色石蕊试液。一段时间后将观察到 , 这是因为。如果用浓硫酸代替浓盐酸做上述实验,不能观察到相同的现象,理由是。
 23. 生石灰常用作食品干燥剂.久置的生石灰里可能会含有氧化钙、氢氧化钙、碳酸钙三种物质中的一种或几种(假设久制的生石灰中不再含有其它成分)。为了探究久置的生石灰的成分,某校化学兴趣小组进行了以下探究活动。
23. 生石灰常用作食品干燥剂.久置的生石灰里可能会含有氧化钙、氢氧化钙、碳酸钙三种物质中的一种或几种(假设久制的生石灰中不再含有其它成分)。为了探究久置的生石灰的成分,某校化学兴趣小组进行了以下探究活动。【设计实验】取0.94g久置的生石灰样品放入烧杯中,进行了以下探究实验,如图所示:
 (1)、生石灰可以做干燥剂,可推测生石灰的性质是(2)、向0.2g滤渣A中滴加稀盐酸,有气泡产生,说明久置的生石灰样品中一定含有 (填写化学式).(3)、②中反应过程中的实验现象是 .24. 化学实验需要不断改进和创新,请分析以下实验
(1)、生石灰可以做干燥剂,可推测生石灰的性质是(2)、向0.2g滤渣A中滴加稀盐酸,有气泡产生,说明久置的生石灰样品中一定含有 (填写化学式).(3)、②中反应过程中的实验现象是 .24. 化学实验需要不断改进和创新,请分析以下实验实验一 实验二 实验三 煅烧石灰石并检验气体产物 铁丝在氧气中燃烧 研究二氧化碳的性质 

 (1)、【实验一】A处发生反应的化学方程式为 , 该反应属于(填“分解”或“化合”)反应;B处发生反应的化学方程式为(2)、【实验二】铁丝燃烧的化学方程式为;(3)、【实验三】同时打开弹簧夹K1、K2 , 一段时间后,C烧杯中的现象是 , E中液体变为色,接着同时关闭K1、K2 , D中多孔隔板处依次观察到的现象是(用字母a、b、c对下图排序)
(1)、【实验一】A处发生反应的化学方程式为 , 该反应属于(填“分解”或“化合”)反应;B处发生反应的化学方程式为(2)、【实验二】铁丝燃烧的化学方程式为;(3)、【实验三】同时打开弹簧夹K1、K2 , 一段时间后,C烧杯中的现象是 , E中液体变为色,接着同时关闭K1、K2 , D中多孔隔板处依次观察到的现象是(用字母a、b、c对下图排序)
四、解答题(本题共7小题,第25、26、27、30题各6分,28、29题各8分,31题10分,共50分)
-
25. 去年5月,我国运用“蓝鲸一号”钻探平台,在南海神狐海域首次实现可燃冰试采成功。可燃冰,学名天然气水合物,其化学式为CH4•8H2O,它是天然气的固体状态。(1)、从化学式看,可燃冰属于(填“纯净物”或“混合物”)。(2)、可燃冰中C、H元素的质量比是。(3)、可燃冰中的C元素的质量分数是。26. 小金同学用稀释98%的浓硫酸的方法制得4.9%的稀硫酸,将量取好的浓硫酸沿着烧杯壁慢慢倒入量取好的水中,并用玻璃棒不断搅拌。小金同学发现如果将水倒入浓硫酸,水会迅速沸腾,导致酸液飞溅,造成危险。于是小金同学产生了疑问,为什么浓硫酸倒入水中时水不易沸腾,而水倒入浓硫酸中时水容易沸腾呢?请你结合所学知识帮助小金同学解释,已知浓度为98%的浓硫酸的密度是1.84g/cm3。27. 实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图所示。请回答下列问题。
 (1)、二氧化锰作为催化剂在化学反应前后本身的都没有发生变化。(2)、反应生成氧气的质量为g。(3)、求所用过氧化氢溶液的质量分数。28. 实验室用加热氯酸钾与二氧化锰混合物的方法制取氧气,已知二氧化锰的质量为0.3g,加热前称得混合物总质量为24.8g,加热一段时间后称得剩余固体质量为20.0g。(1)、反应产生氧气的质量为(2)、计算反应后剩余固体中氯化钾的质量分数。(3)、计算剩余固体中钾元素的质量分数。29. 某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。(提示:Na2CO3+2HCl=2NaCl+H2O+CO2↑)
(1)、二氧化锰作为催化剂在化学反应前后本身的都没有发生变化。(2)、反应生成氧气的质量为g。(3)、求所用过氧化氢溶液的质量分数。28. 实验室用加热氯酸钾与二氧化锰混合物的方法制取氧气,已知二氧化锰的质量为0.3g,加热前称得混合物总质量为24.8g,加热一段时间后称得剩余固体质量为20.0g。(1)、反应产生氧气的质量为(2)、计算反应后剩余固体中氯化钾的质量分数。(3)、计算剩余固体中钾元素的质量分数。29. 某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。(提示:Na2CO3+2HCl=2NaCl+H2O+CO2↑)
实验次数
1
2
3
碳酸钠质量/克
0.53
1.06
2.12
反应前装置总质量/克
66.33
66.86
67.92
反应后装置总质量/克
66.19
66.62
67.42
(1)、计算第1次实验反应产生的二氧化碳质量;(2)、分析数据发现每次反应前后装置的总质量均不相等,请以第1次的反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3g/L,二氧化碳密度取2.0g/L,g取10N/Kg,结果保留两位小数)30. 碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸。已知:NaHCO3+HCl=NaCl+CO2↑+H2O,为了测定药片中碳酸氢钠的质量分数,小科进行了如下实验:取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:实验序号
1
2
3
碳酸氢钠片样品质量/g
3.0
3.0
3.0
反应前总质量/g
193.8
194.6
193.6
反应后总质量/g
192.6
193.6
192.5
二氧化碳质量/g
请计算药片中碳酸氢钠的质量分数。
31.工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl3与NaOH反应的化学方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl.请回答下列问题:
 (1)、FeCl3与NaOH恰好完全反应时,生成沉淀的质量是g;(2)、所滴加的NaOH溶液质量为160克时,溶液中的溶质是;
(1)、FeCl3与NaOH恰好完全反应时,生成沉淀的质量是g;(2)、所滴加的NaOH溶液质量为160克时,溶液中的溶质是;
(3)、该工业盐酸中HCl的质量分数是多少?