高中化学人教版(新课标)选修4 第四章第二节 化学电源
试卷更新日期:2020-10-30 类型:同步测试
一、单选题
-
1. 液体燃料电池相比于气体燃料电池具有体积小等优点:一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )
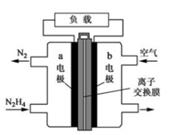 A、b极发生氧化反应 B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O C、放电时,电子从b极经过负载流向a极 D、其中的离子交换膜需选用阳离子交换膜2. 一种用于驱动潜艇的液氨 液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )
A、b极发生氧化反应 B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O C、放电时,电子从b极经过负载流向a极 D、其中的离子交换膜需选用阳离子交换膜2. 一种用于驱动潜艇的液氨 液氧燃料电池原理示意如图,下列有关该电池说法正确的是( ) A、该电池工作时,每消耗22.4LNH3转移3mol电子 B、电子由电极A经外电路流向电极B C、电池工作时,OH-向电极B移动 D、电极B上发生的电极反应为: H2O3. 利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是( )
A、该电池工作时,每消耗22.4LNH3转移3mol电子 B、电子由电极A经外电路流向电极B C、电池工作时,OH-向电极B移动 D、电极B上发生的电极反应为: H2O3. 利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是( ) A、a电极是负极,b电极是正极 B、负极区发生的反应是2NH3 - 6e-=N2+6H+ C、正极区,每消耗标准状况下2.24 L O2 , a向b电极转移0.4 mol电子 D、电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极4. “水”电池是一种利用淡水与海水之间含盐量差别进行发电的电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,如图以“水”电池为电源电解酸性FeCl2溶液,X电极附近溶液先变黄,下列有关分析错误的是( )
A、a电极是负极,b电极是正极 B、负极区发生的反应是2NH3 - 6e-=N2+6H+ C、正极区,每消耗标准状况下2.24 L O2 , a向b电极转移0.4 mol电子 D、电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极4. “水”电池是一种利用淡水与海水之间含盐量差别进行发电的电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,如图以“水”电池为电源电解酸性FeCl2溶液,X电极附近溶液先变黄,下列有关分析错误的是( ) A、该装置只涉及两种能量之间的转化 B、在线路中安装电压调节装置,可通过现象判断Fe2+和Cl-的还原性强弱 C、“水”电池内Na+不断向正极移动 D、Ⅱ为负极,其电极反应式为Ag+Cl--e-=AgCl5. 有四种燃料电池:A.固体氧化物燃料电池、B.碱性氢氧化物燃料电池、C.质子交换膜燃料电池、D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )A、
A、该装置只涉及两种能量之间的转化 B、在线路中安装电压调节装置,可通过现象判断Fe2+和Cl-的还原性强弱 C、“水”电池内Na+不断向正极移动 D、Ⅱ为负极,其电极反应式为Ag+Cl--e-=AgCl5. 有四种燃料电池:A.固体氧化物燃料电池、B.碱性氢氧化物燃料电池、C.质子交换膜燃料电池、D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )A、 B、
B、 C、
C、 D、
D、 6. 熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为 (x=5~3,难溶于熔融硫),下列说法错误的是( )
6. 熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为 (x=5~3,难溶于熔融硫),下列说法错误的是( ) A、Na2S4的电子式为
A、Na2S4的电子式为 B、放电时正极反应为
C、Na和Na2Sx分别为电池的负极和正极
D、该电池是以 为隔膜的二次电池
7. 微生物燃料电池(MFC)为可再生能源的开发和难降解废弃物的处理提供了一条新途径。某微生物燃料电池示意图如图所示(假设废弃物为乙酸盐)。下列说法错误的是( )
B、放电时正极反应为
C、Na和Na2Sx分别为电池的负极和正极
D、该电池是以 为隔膜的二次电池
7. 微生物燃料电池(MFC)为可再生能源的开发和难降解废弃物的处理提供了一条新途径。某微生物燃料电池示意图如图所示(假设废弃物为乙酸盐)。下列说法错误的是( ) A、甲室菌为好氧菌,乙室菌为厌氧菌 B、甲室的电极反应式为 C、该微生物燃料电池(MFC)电流的流向:由b经导线到a D、电池总反应式为8. 要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体相结合的装置示意图如图,当该装置工作时,下列说法正确的是( )
A、甲室菌为好氧菌,乙室菌为厌氧菌 B、甲室的电极反应式为 C、该微生物燃料电池(MFC)电流的流向:由b经导线到a D、电池总反应式为8. 要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体相结合的装置示意图如图,当该装置工作时,下列说法正确的是( ) A、盐桥中K+向X极移动 B、电路中流过7.5mol电子时,共产生标准状况下N2的体积为44.8L C、该装置实现了将电能转化为化学能 D、Y极发生的反应为2NO3--10e-+6H2O=N2↑+12OH- , 周围pH增大9. 锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。
A、盐桥中K+向X极移动 B、电路中流过7.5mol电子时,共产生标准状况下N2的体积为44.8L C、该装置实现了将电能转化为化学能 D、Y极发生的反应为2NO3--10e-+6H2O=N2↑+12OH- , 周围pH增大9. 锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。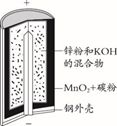
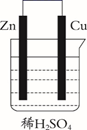
下列关于原电池和干电池的说法错误的是( )
A、两者正极材料不同 B、MnO2的放电产物可能是KMnO4 C、两者负极反应式均为Zn失电子 D、原电池中Zn与稀H2SO4存在自放电现象二、综合题
-
10. 下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,试回答下列问题:
 (1)、写出氢氧燃料电池工作时负极的电极反应式:;(2)、若将此燃料电池改为以甲烷和氧气为原料,则电池工作时,负极反应式为 。11. 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。(1)、氢气燃烧,该反应是反应(填“吸热”或“放热”),这是由于反应物的总能量(填“大于”“小于”或“等于”)生成物的总能量;从化学反应的本质来看,是由于断裂反应物中的化学键吸收的总能量(填“大于”“小于”或“等于”)形成产物的化学键放出的总能量。(2)、通过氢气的燃烧反应,可以把氢气中储存的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中储存的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。
(1)、写出氢氧燃料电池工作时负极的电极反应式:;(2)、若将此燃料电池改为以甲烷和氧气为原料,则电池工作时,负极反应式为 。11. 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。(1)、氢气燃烧,该反应是反应(填“吸热”或“放热”),这是由于反应物的总能量(填“大于”“小于”或“等于”)生成物的总能量;从化学反应的本质来看,是由于断裂反应物中的化学键吸收的总能量(填“大于”“小于”或“等于”)形成产物的化学键放出的总能量。(2)、通过氢气的燃烧反应,可以把氢气中储存的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中储存的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。该电池的正极是(填“a电极”或“b电极”),电极反应式为 , 该电极上的物质发生反应的反应类型是(填“氧化反应”或“还原反应”)。
 12. 电能是现代社会应用最广泛的能源之一。(1)、如图所示装置中,Zn是极(填“正”或“负”)。
12. 电能是现代社会应用最广泛的能源之一。(1)、如图所示装置中,Zn是极(填“正”或“负”)。 (2)、如图所示装置可将(写化学方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是。(3)、氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图所示。下列有关氢氧燃料电池的说法,正确的是。
(2)、如图所示装置可将(写化学方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是。(3)、氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图所示。下列有关氢氧燃料电池的说法,正确的是。
①电极b是正极
②外电路中电子由电极b通过导线流向电极a
③该电池的总反应:2H2+O2=2H2O
13. 化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)、上述反应Ⅰ是原子经济性反应,写出化学反应方程式。(2)、在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是(填一项即可)。(3)、一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是。a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)、生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:化学键
H-H
C-O
CO中的 C
 O
OH-O
C-H
E(kJ)
m
n
E1
x
y
根据相关数据计算拆开1molC
 O所需的能量E1=kJ。(5)、H2还原CO2电化学法制备甲醇的工作原理如下图所示:
O所需的能量E1=kJ。(5)、H2还原CO2电化学法制备甲醇的工作原理如下图所示:
通入H2 的一端是电池的极(填“正”或“负”),通入CO2的一端发生的电极反应式为。