高中化学人教版(新课标)选修4 第三章第二节 水的电离和溶液的酸碱性
试卷更新日期:2020-10-30 类型:同步测试
一、单选题
-
1. 常温下,下列溶液中水的电离程度最大的是( )A、pH=0的硫酸 B、0.01mol/L NaOH溶液 C、pH=10的纯碱溶液 D、pH=5的氯化铵溶液2. 下列说法正确的是( )A、pH为6.8的溶液一定呈酸性 B、中和pH和体积均相等的醋酸和盐酸溶液,所需NaOH的物质的量相同 C、0.1mol·L-1的醋酸溶液加水稀释,溶液中所有离子的浓度都减小 D、0.1mol·L-1的氨水溶液中:c(NH4+) +c(NH3·H2O) =0.1mol·L-13. 对室温下pH相同、体积相同的氨水与氢氧化钠两种稀溶液,分别采取下列措施,有关叙述正确的是( )A、温度均升高20℃,两溶液的pH均不变 B、加入适量氯化铵固体后,两溶液的pH均减小 C、加水稀释100倍后,氨水中c(OH-)比氢氧化钠溶液中的小 D、与足量的氯化铁溶液反应,产生的氢氧化铁沉淀一样多4. 室温下,向20.00 mL 0.1000 mol·L−1盐酸中滴加0.1000 mol·L−1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5。下列说法不正确的是( )
 A、选择变色范围在pH突变范围内的指示剂,可减小实验误差 B、用移液管量取20.00 mL 0.1000 mol·L−1盐酸时,移液管水洗后需用待取液润洗 C、NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂 D、V(NaOH)=10.00 mL 时,pH约为1.55. 25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是( )A、c(OH-) B、pH C、Kb D、n(H+)·n(OH-)6. 25℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0 ,下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,pH不变7. 某温度下,水的离子积KW=10-13 , 关于该温度下水电离的说法正确的是( )A、pH=2的盐酸与pH=12的NaOH溶液中水电离出的H+浓度之比为10:1 B、向水中加入少量硫酸氢钠固体或氯化铁固体,水的电离平衡均逆向移动 C、纯水的pH=6.5,显酸性 D、pH均为2的CH3COOH溶液与H2SO4溶液中水电离出的H+浓度不同8. 下图是不同温度(T1、T2)下溶液中水的电离常数Kw变化曲线,有关说法正确的是( )
A、选择变色范围在pH突变范围内的指示剂,可减小实验误差 B、用移液管量取20.00 mL 0.1000 mol·L−1盐酸时,移液管水洗后需用待取液润洗 C、NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂 D、V(NaOH)=10.00 mL 时,pH约为1.55. 25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是( )A、c(OH-) B、pH C、Kb D、n(H+)·n(OH-)6. 25℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0 ,下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,pH不变7. 某温度下,水的离子积KW=10-13 , 关于该温度下水电离的说法正确的是( )A、pH=2的盐酸与pH=12的NaOH溶液中水电离出的H+浓度之比为10:1 B、向水中加入少量硫酸氢钠固体或氯化铁固体,水的电离平衡均逆向移动 C、纯水的pH=6.5,显酸性 D、pH均为2的CH3COOH溶液与H2SO4溶液中水电离出的H+浓度不同8. 下图是不同温度(T1、T2)下溶液中水的电离常数Kw变化曲线,有关说法正确的是( )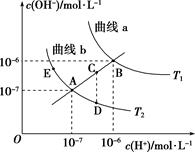 A、图中温度T1 <T2 B、T1温度下pH=6的溶液有弱酸性 C、两条曲线中四个点Kw间的关系:B>A=D=E D、E,D两点水的电离均被抑制,而Kw相等9. 中和相同体积、相同pH值的H2SO4、HCl和CH3COOH三种稀溶液,所需相同浓度的NaOH溶液的体积为V1、V2和V3 , 则( )A、V1>V2>V3 B、V3>V2>V1 C、V3>V1=V2 D、V1>V2=V310. 相同温度,相同物质的量浓度的五种溶液:①NH4Cl ②NaHSO4③NaCl ④CH3COONa ⑤Na2CO3 , pH 按由大到小的顺序排列,正确的是( )A、⑤>④>①>③>② B、⑤>④>③>①>② C、⑤>④>①>②>③ D、④>⑤>③>①>②11. 常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,则混合液的pH为( )A、7.2 B、8 C、6 D、无法计算12. 今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法错误的是( )A、①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 B、分别加水稀释10倍,四种溶液的pH①>②>④>③ C、①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-) D、V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9
A、图中温度T1 <T2 B、T1温度下pH=6的溶液有弱酸性 C、两条曲线中四个点Kw间的关系:B>A=D=E D、E,D两点水的电离均被抑制,而Kw相等9. 中和相同体积、相同pH值的H2SO4、HCl和CH3COOH三种稀溶液,所需相同浓度的NaOH溶液的体积为V1、V2和V3 , 则( )A、V1>V2>V3 B、V3>V2>V1 C、V3>V1=V2 D、V1>V2=V310. 相同温度,相同物质的量浓度的五种溶液:①NH4Cl ②NaHSO4③NaCl ④CH3COONa ⑤Na2CO3 , pH 按由大到小的顺序排列,正确的是( )A、⑤>④>①>③>② B、⑤>④>③>①>② C、⑤>④>①>②>③ D、④>⑤>③>①>②11. 常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,则混合液的pH为( )A、7.2 B、8 C、6 D、无法计算12. 今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法错误的是( )A、①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 B、分别加水稀释10倍,四种溶液的pH①>②>④>③ C、①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-) D、V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9二、综合题
-
13. 某学习小组为了探究CH3COOH的电离情况,进行了如下实验。(1)、(实验一)测定醋酸溶液中CH3COOH的物质的量浓度。
用 0.2000mol/L 的 NaOH 溶液滴定 20.00mL 醋酸溶液,3 次滴定所消耗NaOH溶液的体积如下:
实验次数
1
2
3
消耗NaOH 溶液的体积/mL
20.05
20.00
19.95
量取 20.00 mL 醋酸溶液所用的仪器是(填字母)



a
b
c
d
(2)、以上醋酸溶液中CH3COOH的物质的量浓度为(3)、(实验二)探究浓度对CH3COOH电离程度的影响。用 pH 计测定 25℃时不同浓度的醋酸的 pH,结果如下:
浓度/(mol·L-1)
0.2000
0.1000
0.0100
pH
2.83
2.88
3.38
根据表中数据可知CH3COOH是电解质(填“强”或“弱”) 得出此结论的依据是
(4)、写出CH3COOH的电离方程式14. 某实验小组同学为了测定工业纯碱的纯度,进行了一系列实验。(1)、和索氏制碱法相比,侯氏制碱法的优势有;(2)、工业纯碱中常含有少量NaCl杂质,解释原因 , 检验是否含有氯化钠杂质的方法为;(3)、使用重量法测定纯碱的纯度,用到的试剂有;(4)、使用滴定法测定纯碱的纯度,用(填仪器名称)称量1.200g工业纯碱样品,溶解,用1mol/L盐酸做标准液,滴定过程中溶液pH变化和生成CO2的量如图所示,A点溶液呈碱性的原因 , 计算该工业纯碱样品的质量分数。(计算结果保留两位小数)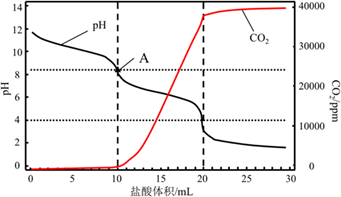 。15. 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
。15. 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,实验编号
待测NaOH溶液的体积/mL
HCl溶液的体积/mL
1
25.00
24.41
2
25.00
24.39
3
25.00
24.60

回答下列问题:
(1)、右图中甲为滴定管,乙为滴定管(填“酸式”或“碱式”)(2)、实验中,需要润洗的仪器是:。(3)、取待测液NaOH溶液25.00mL于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是。(4)、若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 。(5)、未知浓度的NaOH溶液的物质的量浓度为mol/l。16. 盐酸、醋酸是中学化学常见的两种酸。回答下列问题:(1)、在体积均为1L,pH均等于2的盐酸和醋酸溶液中,投入0.65g锌粒,下图所示符合客观事实的是(填数字代号) (2)、25℃时,相同pH的盐酸和醋酸溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。X代表(填“盐酸”或“醋酸溶液”)。
(2)、25℃时,相同pH的盐酸和醋酸溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。X代表(填“盐酸”或“醋酸溶液”)。 (3)、常温下,若使pH=3的盐酸与pH=9的Ba(OH)2溶液混合使其成为pH=7的溶液,混合时盐酸和Ba(OH)2溶液的体积比为。(4)、25℃时,用20mL0.1mol·L-1 . CH3COOH溶液滴定一定浓度的NaOH溶液,所加入NaOH溶液的体积(V)和滴定过程中pH的关系曲线如图所示。该滴定过程中应使用的指示剂为(填“酚酞”或“甲基橙”)
(3)、常温下,若使pH=3的盐酸与pH=9的Ba(OH)2溶液混合使其成为pH=7的溶液,混合时盐酸和Ba(OH)2溶液的体积比为。(4)、25℃时,用20mL0.1mol·L-1 . CH3COOH溶液滴定一定浓度的NaOH溶液,所加入NaOH溶液的体积(V)和滴定过程中pH的关系曲线如图所示。该滴定过程中应使用的指示剂为(填“酚酞”或“甲基橙”)