高中化学人教版(新课标)必修1 第四章测试题
试卷更新日期:2020-10-30 类型:单元试卷
一、单选题
-
1. 下列关于浓HNO3和浓H2SO4的叙述中正确的是( )A、常温下都不能用铝制容器贮存 B、露置在空气中,容器内酸液的浓度都降低 C、常温下都能与铜较快反应 D、滴在紫色石蕊试纸上,试纸都只变红2. 84消毒液(pH约为12,有效成分为NaClO)露置在空气中发生变质,此过程中( )A、未发生复分解反应 B、Na、O化合价未变 C、碱性逐渐增强 D、会产生氧气3. 向浓氨水中加入生石灰可以制取氨气,以下不会涉及到的反应是( )A、NH3·H2O NH3+H2O B、NH4++H2O NH3·H2O+H+ C、CaO+H2O→Ca(OH)2 D、NH4++OH- NH3·H2O4. 下列有关物质的叙述中,错误的是( )A、碳酸钠溶液保存在配有橡胶塞的细口瓶中,氢氟酸通常保存在塑料瓶中 B、石灰石是制备玻璃、水泥的原料之一 C、水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品 D、合金比它的各成分金属的熔点低,硬度大,电解氧化铝可以获得铝单质5. 在下列各溶液中逐渐通入CO2气体直至过量,会出现沉淀先产生后消失现象的是( )
①饱和Na2CO3溶液 ②澄清石灰水 ③BaCl2溶液 ④K2SiO3溶液 ⑤NaAlO2溶液
A、全部 B、只有③④ C、除①⑤ D、只有②6. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、NaCl(aq) Na(s) NaOH(aq) B、Al(s) Al(OH)3(s) AlCl3(s) C、HCl(aq) Cl2 Ca(ClO)2 D、AgNO3(aq) [Ag(NH3)2]+(aq) Ag(s)7. 下列关于Cl2的实验操作能达到实验目的的是( )A、 用装置甲制取少量Cl2
B、
用装置甲制取少量Cl2
B、 用装置乙除去Cl2中的HCl
C、
用装置乙除去Cl2中的HCl
C、 用装置丙收集Cl2
D、
用装置丙收集Cl2
D、 用装置丁吸收尾气
8. 在探究SO2性质的实验中,下列根据实验现象得出的结论不正确的是( )A、向SO2的水溶液中滴加紫色的石蕊试液,溶液变红,说明溶液中有H+ B、向SO2的水溶液中滴加Ba(NO3)2溶液,溶液变浑浊,该白色沉淀为BaSO3 C、向品红溶液中不断地通入SO2 , 溶液红色褪去,说明SO2具有漂白性 D、向酸性KMnO4溶液中通入SO2 , 溶液紫色褪去,说明SO2具有还原性9. 如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )
用装置丁吸收尾气
8. 在探究SO2性质的实验中,下列根据实验现象得出的结论不正确的是( )A、向SO2的水溶液中滴加紫色的石蕊试液,溶液变红,说明溶液中有H+ B、向SO2的水溶液中滴加Ba(NO3)2溶液,溶液变浑浊,该白色沉淀为BaSO3 C、向品红溶液中不断地通入SO2 , 溶液红色褪去,说明SO2具有漂白性 D、向酸性KMnO4溶液中通入SO2 , 溶液紫色褪去,说明SO2具有还原性9. 如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( ) A、溶液B中发生的反应为2SO2+O2=2SO3 B、可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ C、由以上流程可推知氧化性:Fe3+>O2>SO42- D、此工艺的优点之一是物质能循环利用10. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )
A、溶液B中发生的反应为2SO2+O2=2SO3 B、可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ C、由以上流程可推知氧化性:Fe3+>O2>SO42- D、此工艺的优点之一是物质能循环利用10. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )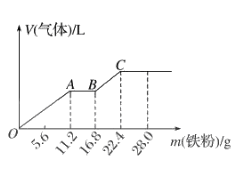 A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-111. 铜与浓硫酸反应的装置如图所示。下列描述合理的是( )
A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-111. 铜与浓硫酸反应的装置如图所示。下列描述合理的是( )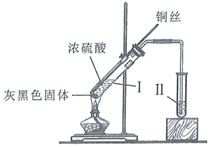 A、反应过程中,试管Ⅰ中出现灰黑色固体是 B、反应结束后,为观察溶液颜色需向试管Ⅰ中加入水 C、若试管Ⅱ盛放紫色石蕊溶液,可观察到紫色褪至无色 D、为验证气体产物具有还原性,试管Ⅱ可盛放溴水12. 现有2.8gFe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断错误的是( )A、反应后溶液中c(NO3-)=0.85mol/L B、反应后的溶液最多还能溶解1.4gFe C、反应后溶液中铁元素可能以Fe3+形式存在 D、1.12L气体只能是NO13. 几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断错误的是( )
A、反应过程中,试管Ⅰ中出现灰黑色固体是 B、反应结束后,为观察溶液颜色需向试管Ⅰ中加入水 C、若试管Ⅱ盛放紫色石蕊溶液,可观察到紫色褪至无色 D、为验证气体产物具有还原性,试管Ⅱ可盛放溴水12. 现有2.8gFe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断错误的是( )A、反应后溶液中c(NO3-)=0.85mol/L B、反应后的溶液最多还能溶解1.4gFe C、反应后溶液中铁元素可能以Fe3+形式存在 D、1.12L气体只能是NO13. 几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断错误的是( ) A、若L为强碱,则E可能为NaCl溶液、F为钾 B、若L为强酸,则E可能为NaHS、F为HNO3 C、若L为弱酸,则E可能为Mg、F为CO2 D、若L为强酸,则E可能为NH4Cl、F为Ca(OH)214. 在烧瓶中加入铜片和稀硝酸以制取较纯净的一氧化氮,反应开始后发现烧瓶中充满红棕色气体,这时的操作应是( )A、立即接上收集容器,用向下排空气法收集 B、立即用排空气法收集 C、待烧瓶中红棕色气体消失后,用排水法收集 D、待烧瓶中的红棕色气体消失后,用向上排空气法收集
A、若L为强碱,则E可能为NaCl溶液、F为钾 B、若L为强酸,则E可能为NaHS、F为HNO3 C、若L为弱酸,则E可能为Mg、F为CO2 D、若L为强酸,则E可能为NH4Cl、F为Ca(OH)214. 在烧瓶中加入铜片和稀硝酸以制取较纯净的一氧化氮,反应开始后发现烧瓶中充满红棕色气体,这时的操作应是( )A、立即接上收集容器,用向下排空气法收集 B、立即用排空气法收集 C、待烧瓶中红棕色气体消失后,用排水法收集 D、待烧瓶中的红棕色气体消失后,用向上排空气法收集二、填空题
-
15. 为探究硫酸亚铁的分解产物,将已加热至恒重的装置A接入如图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为、(填标号)。C、D中有气泡冒出,并可观察到的现象分别为。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式。
16. 现代化城市建设离不开各种材料。(1)、水泥具有性和强吸水性;水泥砂浆是、和水的混合物,是建筑用黏合剂;混凝土是、和的混合物,用钢筋做结构的混凝土强度很大。(2)、玻璃生产的主要原料是、和。三、实验探究题
-
17. 海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
 (1)、实验室焙烧海带,需要下列仪器中的(填序号)。
(1)、实验室焙烧海带,需要下列仪器中的(填序号)。a.试管b.烧杯c.坩埚d.泥三角e.铁三脚架f.酒精灯
(2)、指出提取碘的过程中有关的实验操作③的名称是 , 所用主要仪器是。(3)、提取碘的过程中,可选择的有机试剂是________________A、甲苯、酒精 B、四氯化碳、苯 C、汽油、乙酸 D、汽油、甘油(4)、从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出实验装置图中的不正确之处:
①;
②;
③。
(5)、进行上述蒸馏操作时,使用水浴加热的原因是 , 最后晶态碘在(填仪器名称)里聚集。18. 某处工厂排出的烟道气中含氮氧化物(主要为NO、NO2)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示: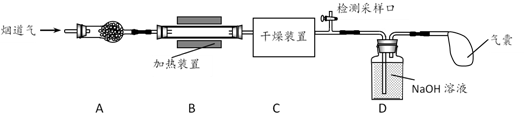 (1)、装置A中放置无碱玻璃棉,其目的是除去。为保证检测的准确性,装置C中盛放的化学试剂可以是(填字母)。
(1)、装置A中放置无碱玻璃棉,其目的是除去。为保证检测的准确性,装置C中盛放的化学试剂可以是(填字母)。a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
(2)、装置D中主要发生:2NaOH+2NO2=NaNO2+NaNO3+H2O;2NaOH+NO+NO2=2NaNO2+H2O①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为(填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3- , 发生反应的离子方程式是。
(3)、溶液中NO3-直接排放在水体中也会造成污染,现用活泼金属将溶液中NO3-转化为N2 , 实现氮元素的脱除,具体步骤如下:步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因。
(4)、气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理。HClO氧化NO生成NO3-和Cl- , 发生反应的离子方程式是。19. 亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如图装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠(夹持装置和A中加热装置已略,气密性已检验)。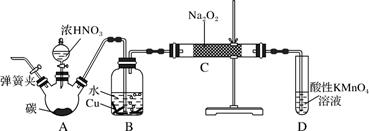
查阅资料:
①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)、B中观察到的主要现象是 , D装置的作用是。(2)、经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称)。20. 实验室里研究不同价态硫元素之间的转化 (1)、A中发生反应的化学方程式为。(2)、B中的现象是。(3)、C中出现淡黄色沉淀,反应中Na2S做 (填“氧化剂”或“还原剂”)。(4)、D溴水褪色,该反应S元素的价态变化是由+4价变为价。(5)、某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,。(6)、E的作用是 , 离子方程式为。(7)、上述实验体现SO2 的性质有。21. 硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒。某化学兴趣小组设计了制取H2S气体并验证其性质的实验。实验装置如下图所示。
(1)、A中发生反应的化学方程式为。(2)、B中的现象是。(3)、C中出现淡黄色沉淀,反应中Na2S做 (填“氧化剂”或“还原剂”)。(4)、D溴水褪色,该反应S元素的价态变化是由+4价变为价。(5)、某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,。(6)、E的作用是 , 离子方程式为。(7)、上述实验体现SO2 的性质有。21. 硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒。某化学兴趣小组设计了制取H2S气体并验证其性质的实验。实验装置如下图所示。
已知:①H2S在水中的溶解度为1:2(体积比),其水溶液称为氢硫酸;
②H2S可与许多金属离子反应生成沉淀;
③H2S有极强的还原性。
请回答下列问题:
(1)、装置A为制备H2S气体的发生装置,该装置还可以制取的气体有(任填一种)。装置A中的稀硫酸若换为稀硝酸,是否可行?其理由是。(2)、装置B中溴水橙色褪去,证明溴的非金属性比硫(填“强”或“弱”)。(3)、装置C中有黑色沉淀(CuS)生成,装置D中有淡黄色沉淀生成,说明Fe3+的氧化性比Cu2+强,请设计实验证明这一结论:。(4)、装置E中生成淡黄色沉淀,该反应的离子方程式为。(5)、装置F中的现象为 , 该反应的离子方程式为。四、综合题
-
22. 海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)、步骤③的操作名称是 , 碘离子在酸性环境中也能被氧气氧化,请写出相关离子方程式是。(2)、步骤⑤中萃取剂也可用四氯化碳的理由是 , 该步骤所用主要玻璃仪器的名称是。23. 化学是一门实用性很强的科学。根据题意填空:(1)、饱和FeCl3溶液滴入沸水中并煮沸1~2分钟,光束通过该分散系时,可观察到丁达尔效应,则该分散系是(填“胶体”或“溶液”)。(2)、某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有(填“钠”或“钾”)元素;(3)、海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是(填“生石灰”或“盐酸”)。(4)、盛有浓硫酸的烧杯敞口放置一段时间,质最增加,则浓硫酸表现出 (填“吸水性”或“脱水性”)。(5)、浓硫酸与碳共热时发生反应2H2SO4(浓)+C CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出 , 氧化产物是。24. 将6.4g铜与足量的浓硝酸充分反应,铜没有剩余。试计算:(1)、参加反应的硝酸的物质的量(2)、生成的NO2的体积(标准状况下);(3)、将反应后的溶液用水稀释到100mL,计算溶液中硝酸铜的物质的量浓度。