高中化学人教版(新课标)必修1 第四章第四节 氨 硝酸 硫酸
试卷更新日期:2020-10-30 类型:同步测试
一、单选题
-
1. 下列关于自然界中氮循环(如图)的说法不正确的是:( )
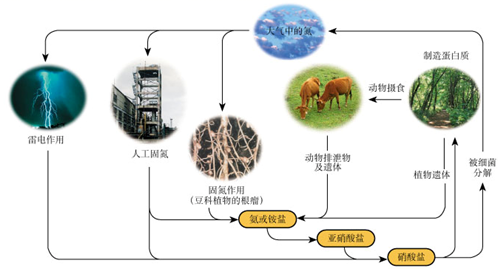 A、氮元素均被氧化 B、工业合成氨属于人工固氮 C、含氮无机物和含氮有机物可相互转化 D、碳、氢、氧三种元素也参与了氮循环2. 下列有关硫、氮单质及其化合物的叙述正确的是( )A、SO2、NO2均为酸性氧化物 B、“雷雨肥庄稼”与氮的固定有关 C、硫粉在过量的纯氧中燃烧可以生成SO3 D、铜片与稀盐酸不反应,向溶液中通入NO2后,铜片质量不变3. 下列制取、干燥、收集NH3并进行尾气处理的装置和原理能达到实验目的的是( )A、制备NH3
A、氮元素均被氧化 B、工业合成氨属于人工固氮 C、含氮无机物和含氮有机物可相互转化 D、碳、氢、氧三种元素也参与了氮循环2. 下列有关硫、氮单质及其化合物的叙述正确的是( )A、SO2、NO2均为酸性氧化物 B、“雷雨肥庄稼”与氮的固定有关 C、硫粉在过量的纯氧中燃烧可以生成SO3 D、铜片与稀盐酸不反应,向溶液中通入NO2后,铜片质量不变3. 下列制取、干燥、收集NH3并进行尾气处理的装置和原理能达到实验目的的是( )A、制备NH3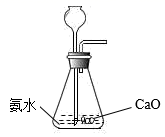 B、干燥NH3
B、干燥NH3 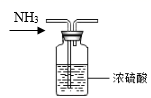 C、收集NH3并验满
C、收集NH3并验满  D、尾气处理
D、尾气处理  4. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )
4. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )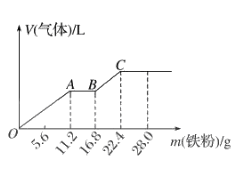 A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-15. A是一种正盐,D相对分子质量比C相对分子质量大16,E是酸,当X无论是强酸还是强碱时都有如下图转化关系。当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素.下列说法不正确的是( )
A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-15. A是一种正盐,D相对分子质量比C相对分子质量大16,E是酸,当X无论是强酸还是强碱时都有如下图转化关系。当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素.下列说法不正确的是( )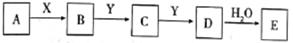 A、D生成E的反应可能是氧化还原反应 B、当X是强酸时,C在常温下是气态单质 C、当X是强酸时,E是H2SO4 D、当X是强碱时,E是HNO36. 下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是( )
A、D生成E的反应可能是氧化还原反应 B、当X是强酸时,C在常温下是气态单质 C、当X是强酸时,E是H2SO4 D、当X是强碱时,E是HNO36. 下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是( )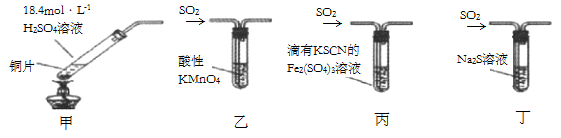 A、若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成 B、图乙装置中溶液的颜色变浅,说明SO2具有漂白性 C、图丙装置中溶液的颜色变浅,说明SO2具有还原性 D、图丁装置中产生淡黄色沉淀,说明SO2或H2SO4具有氧化性7. 将1.92g铜粉投入到某硫酸和硝酸的混合溶液中,其中,硫酸以及硝酸的浓度均为1mol/L,溶液体积为40mL,待充分反应后若只生成NO气体,则最多可收集到标准状况下的NO体积为( )A、336 mL B、112 mL C、448 mL D、224 mL8. 1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2 , 恰好使气体完全溶于水中,则通入O2的体积是( )A、224mL B、168mL C、336mL D、448mL9. 下列依据实验方案和现象对浓硫酸性质做出的判断合理的是( )
A、若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成 B、图乙装置中溶液的颜色变浅,说明SO2具有漂白性 C、图丙装置中溶液的颜色变浅,说明SO2具有还原性 D、图丁装置中产生淡黄色沉淀,说明SO2或H2SO4具有氧化性7. 将1.92g铜粉投入到某硫酸和硝酸的混合溶液中,其中,硫酸以及硝酸的浓度均为1mol/L,溶液体积为40mL,待充分反应后若只生成NO气体,则最多可收集到标准状况下的NO体积为( )A、336 mL B、112 mL C、448 mL D、224 mL8. 1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2 , 恰好使气体完全溶于水中,则通入O2的体积是( )A、224mL B、168mL C、336mL D、448mL9. 下列依据实验方案和现象对浓硫酸性质做出的判断合理的是( )实验方案
实验I:
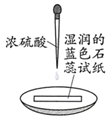
实验II:

实验现象
试纸中心区域变黑,边缘变红
黑色固体溶解,溶液接近无色(溶液中锰元素仅以 存在),产生能使带火星的木条复燃的无色气体
A、由I可知,浓硫酸具有脱水性 B、由I可知,浓硫酸具有弱酸性 C、由II可知,浓硫酸具有强氧化性 D、由II可知,浓硫酸具有吸水性10. 关于氮的变化关系如图:则下列说法不正确的是( )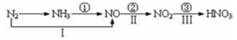 A、路线①②③是工业生产硝酸的主要途径 B、路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 C、上述所有反应都是氧化还原反应 D、上述反应中只有③属于氮的固定
A、路线①②③是工业生产硝酸的主要途径 B、路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 C、上述所有反应都是氧化还原反应 D、上述反应中只有③属于氮的固定二、综合题
-
11. 某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略):
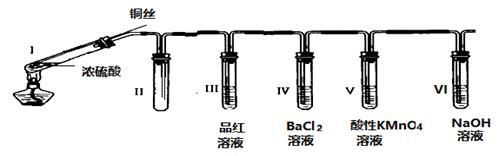
请回答:
(1)、连接好装置后,接下来的操作步骤是(2)、浓硫酸与铜丝反应的化学方程式为(3)、装置II的作用是(4)、下列说法正确的是________________A、反应一段时间后,向试管Ⅰ中的溶液加水,溶液呈蓝色 B、试管III、V中溶液都会褪色,其褪色原理相同 C、取下试管IV并不断振荡,试管中出现浑浊,是因为生成了BaSO4 D、试管VI中NaOH溶液用于吸收尾气,可用Na2CO3溶液代替(5)、某同学根据所学化学知识认为:反应完毕时,不管铜是否过量,硫酸一定有剩余。下列药品能证明反应结束时I试管中确有余酸的是A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉
12. 亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置及尾气吸收装置已省略)和药品探究亚硝酸钠与硫酸反应的气体产物。已知:气体的沸点 : ℃, :21℃
 (1)、写出装置A中发生反应的化学方程式。(2)、B装置中选择的水浴方式为(填“冰水浴”或“热水浴”)。(3)、反应前应先打开弹簧夹,先通一段时间 ,其目的是。(4)、能够说明气体产物中有 的实验现象是。13. 某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
(1)、写出装置A中发生反应的化学方程式。(2)、B装置中选择的水浴方式为(填“冰水浴”或“热水浴”)。(3)、反应前应先打开弹簧夹,先通一段时间 ,其目的是。(4)、能够说明气体产物中有 的实验现象是。13. 某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)、装置A产生氨气,则烧瓶内固体可选用(填字母)。a.烧碱
b.二氧化锰
c.生石灰
d.氯化铵
(2)、B装置的作用是;E装置的作用是 。(3)、F中发生反应的离子方程式为: 。(4)、G处可能逸出黄绿色的气体,可将该气通入盛有 溶液的烧杯来处理,离子方程式为 。(5)、氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: 。(6)、F中产生的黄绿色气体在光照下还能与甲烷反应,写出产物中空间结构为正四面体的有机物的电子式。14. 除去工业尾气中的氮氧化物常用氨催化吸收法。原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。(1)、(一)提供的装置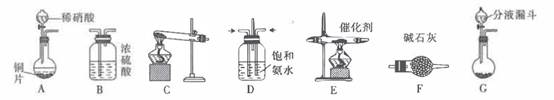
(二)NH3的制取
下列有关实验室制备氨气的说法正确的有(填序号)
①用氮气与氢气反应制取氨气
②用排饱和食盐水的方法收集氨气
③实验室制氨气有时需要加热,有时不需要加热
④用无水氯化钙干燥氨气
(2)、若选择装置G制取氨气,则分液漏斗中盛装的液体试剂是。(3)、若选择装置C制取氨气,则反应的化学方程式是。(4)、(三)模拟尾气的处理选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
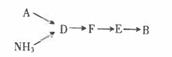
A装置中反应的离子方程式为。
(5)、D装置中的液体可换成 (填字母)。A、H2O B、CCl4 C、浓硫酸(6)、该同学所设计的模拟尾气处理实验存在的明显缺陷是。15. 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:(1)、工业合成氨是制取氮肥的基础。合成氨反应中,反应物 N2 的结构式是 , 产物NH3 的电子式是。(2)、某小组在实验室模拟以 NH3 为原料, 制备少量硝态氮肥 Ca(NO3)2 , 转化途径如下(转化所需试剂及条件已略去)。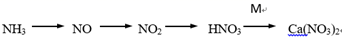
①NO→NO2 的现象是 , NO2→HNO3 的化学方程式为。
②将HNO3 转化为 Ca(NO3)2 , 列举两种不同类别的化合物 M(写化学式) 。
(3)、①NH4HCO3 是一种铵态氮肥,需阴凉处保存,原因是(写化学方程式)。②实验室检验某化肥是铵态氮肥,检验过程中发生反应的离子方程式为。
(4)、过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)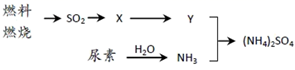
①X可能是SO3 或 , Y是。
②尿素CO(NH2)2是一种常用有机氮肥,缓慢与 H2O 发生非氧化还原反应释放出NH3和另外一种气体,该反应的化学方程式为。
16. 某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mLl 8mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
(1)、请写出锌与硫酸反应产生SO2的化学方程式。(2)、在组装仪器之后,加入试剂之前必须进行的操作是。(3)、长导管B的作用是 , 如果没有这个设计,最终测定的临界浓度会。(填“偏高”、“偏低"或“无影响”)(4)、装置中干燥管C的作用是 , 请简述如何判断硫酸已达临界浓度。(5)、反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:mol/L。(用含a的计算式表示,忽略体积变化)(6)、某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO32-进行滴定,通过滴定出的SO32-的物质的量计算临界浓度,你认为他的这一想法是否可行?(填“可行”或“不可行”),原因是。