高中化学人教版(新课标)必修1 第四章第二节 富集在海水中的元素—氯
试卷更新日期:2020-10-30 类型:同步测试
一、单选题
-
1. 下列关于Cl2的实验操作能达到实验目的的是( )A、
 用装置甲制取少量Cl2
B、
用装置甲制取少量Cl2
B、 用装置乙除去Cl2中的HCl
C、
用装置乙除去Cl2中的HCl
C、 用装置丙收集Cl2
D、
用装置丙收集Cl2
D、 用装置丁吸收尾气
2. 下列颜色变化与氧化还原反应无关的是 ( )A、湿润的红色布条遇氯气褪色 B、棕黄色 FeCl3 饱和溶液滴入沸水中变红褐色 C、紫色酸性 KMnO4 溶液通入乙烯气体后褪色 D、浅黄色 Na2O2 固体露置于空气中逐渐变为白色3. 已知氯的非金属性比氮的强,某同学依据反应3Cl2+2NH3=6HCl+N2进行实验证,设计的实验装置如下:
用装置丁吸收尾气
2. 下列颜色变化与氧化还原反应无关的是 ( )A、湿润的红色布条遇氯气褪色 B、棕黄色 FeCl3 饱和溶液滴入沸水中变红褐色 C、紫色酸性 KMnO4 溶液通入乙烯气体后褪色 D、浅黄色 Na2O2 固体露置于空气中逐渐变为白色3. 已知氯的非金属性比氮的强,某同学依据反应3Cl2+2NH3=6HCl+N2进行实验证,设计的实验装置如下:
下列说法正确的是( )
A、可用图甲所示装置及药品制取Cl2 B、可用图乙所示装置及气流方向净化Cl2 C、可用图丙所示装置及药品制取NH3 D、可用图丁所示装置进行实验,瓶中有白烟产生4. 在给定条件下,下列选项中所示的物质间转化均能实现的是( )A、Al(s) Al(OH)3(s) Al2O3(s) B、FeS2(s) SO2(g) BaSO3(s) C、Cl2(g) NaClO(aq) HClO(aq) D、Fe(s) Fe2O3(s) Fe2(SO4)3(aq)5. 已知:还原性强弱:I- >Fe2+>Br- , 向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是( ) A、a值等于6 B、线段Ⅰ代表Br-的变化情况 C、线段Ⅲ代表Fe2+的变化情况 D、原混合溶液中n(FeBr2)=4mol6. 实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。下列说法中错误的是( )
A、a值等于6 B、线段Ⅰ代表Br-的变化情况 C、线段Ⅲ代表Fe2+的变化情况 D、原混合溶液中n(FeBr2)=4mol6. 实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。下列说法中错误的是( )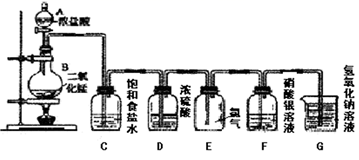 A、装置C的作用是除去氯气中的杂质HCl B、装置F中的现象为有白色沉淀产生 C、实验结束时,应先熄灭酒精灯,再将导管移出装有液体的集气瓶或烧杯 D、该实验中体现了浓盐酸的还原性和酸性7. 常温下,将Cl2缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是( )
A、装置C的作用是除去氯气中的杂质HCl B、装置F中的现象为有白色沉淀产生 C、实验结束时,应先熄灭酒精灯,再将导管移出装有液体的集气瓶或烧杯 D、该实验中体现了浓盐酸的还原性和酸性7. 常温下,将Cl2缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是( )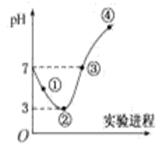 A、曲线③~④段有离子反应:HClO+OH-=ClO-+H2O B、可依据②处数据计算所溶解的n(Cl2) C、③处表示氯气与氢氧化钠溶液恰好反应完全 D、①处c(H+)约为②处c(H+)的2倍
A、曲线③~④段有离子反应:HClO+OH-=ClO-+H2O B、可依据②处数据计算所溶解的n(Cl2) C、③处表示氯气与氢氧化钠溶液恰好反应完全 D、①处c(H+)约为②处c(H+)的2倍二、综合题
-
8. AlCl3是某些有机反应的催化剂,某校学习小组用下面装置制备少量AlCl3。

已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:
(1)、a仪器的名称为;A装置中反应的化学方程式为。(2)、试剂b为。(3)、所用d导管较粗的原因是。(4)、F装置的作用为。(5)、若上图中的D、E装置改为下面装置,D装置中的现象为;用离子方程式表示E中的现象变化。 9. ClO2是一种强氧化性气体,在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图所示装置对其进行制备、收集、吸收并制取NaClO2。
9. ClO2是一种强氧化性气体,在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图所示装置对其进行制备、收集、吸收并制取NaClO2。 (1)、仪器A的名称是。(2)、图中装置有一明显不正确,请指出:。(3)、打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3 , 写出D中所发生反应的离子方程式:。(4)、E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:。(5)、写出一种提高ClO2吸收率的方法:。(6)、E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2- , 当pH≤2时,ClO2-能被I−还原。请补充完整检验E装置溶液中存在少量ClO2-的实验方案:取一定体积E装置中的溶液于分液漏斗中, , 则溶液中存在ClO2-。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)10. 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成 固体,模拟工业上用过氧化氢法制备 固体的实验装置如图所示。
(1)、仪器A的名称是。(2)、图中装置有一明显不正确,请指出:。(3)、打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3 , 写出D中所发生反应的离子方程式:。(4)、E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:。(5)、写出一种提高ClO2吸收率的方法:。(6)、E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2- , 当pH≤2时,ClO2-能被I−还原。请补充完整检验E装置溶液中存在少量ClO2-的实验方案:取一定体积E装置中的溶液于分液漏斗中, , 则溶液中存在ClO2-。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)10. 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成 固体,模拟工业上用过氧化氢法制备 固体的实验装置如图所示。
已知: 熔点-59℃、沸点11℃、 沸点150℃
中的化学方程式:
(1)、 放入仪器 中,仪器 中的药品是(写化学式)。如果仪器 改成分液漏斗,实验过程中可能会出现的实验现象。(2)、 装置有明显缺陷,请绘出合理的装置图(标明气流方向)。(3)、向 装置中通入空气,其作用是赶出 ,然后通过 再到 中反应。通空气不能过快的原因是 , 通空气也不能过慢原因是。(4)、冰水浴冷却的目的是。a.降低 的溶解度 b.减少 的分解 c.使 变为液态 d.加快反应速率
(5)、写出 中发生反应的化学方程式 , 在反应起到作用。假设在反应中消耗掉 则有 电子转移。11. 某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。 (1)、实验室以二氧化锰和浓盐酸制备氯气的离子方程式是。(2)、装置Ⅱ的作用是。(3)、实验过程中,装置IV中的实验现象为;发生反应的化学方程式为。(4)、实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与Ⅲ之间添加如图中的装置(填序号),该装置的作用是。
(1)、实验室以二氧化锰和浓盐酸制备氯气的离子方程式是。(2)、装置Ⅱ的作用是。(3)、实验过程中,装置IV中的实验现象为;发生反应的化学方程式为。(4)、实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与Ⅲ之间添加如图中的装置(填序号),该装置的作用是。 (5)、装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式。12. 为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。
(5)、装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式。12. 为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。 (1)、仪器a的名称是。试剂X 是。(2)、写出装置A中发生反应的化学方程式。(3)、装置E中NaOH溶液的作用是。(4)、反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:ClBr( 填“>"或"<")。(5)、打开装置C中的活塞,将装置C中的溶液逐渐滴入装置D中,振荡。观察到的现象是 , 写出可能发生反应的离子方程式:(写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是。13. 为了探究铁与氯气的反应,某同学甲设计了如下的实验方案及步骤。
(1)、仪器a的名称是。试剂X 是。(2)、写出装置A中发生反应的化学方程式。(3)、装置E中NaOH溶液的作用是。(4)、反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:ClBr( 填“>"或"<")。(5)、打开装置C中的活塞,将装置C中的溶液逐渐滴入装置D中,振荡。观察到的现象是 , 写出可能发生反应的离子方程式:(写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是。13. 为了探究铁与氯气的反应,某同学甲设计了如下的实验方案及步骤。
实验装置图
(1)、用注射器吸取20 mL左右的(填化学式)。(2)、按图所示连接实验装置,并固定在铁架台上。经检验装置不漏气。在硬质玻璃管内加入一定量的细铁丝,一支试管内加入硫氰化钾溶液,另一支试管中加入氢氧化钠溶液。加热硬质玻璃管内铁丝约1 min,然后把注射器中的氯气注入到硬质玻璃管内,观察实验现象。硬质玻璃管内可观察到产生色的烟,盛硫氰化钾溶液的试管内显。
(3)、请写出加入硫氰化钾溶液试管中所发生反应的离子方程式:。其中,氢氧化钠溶液的作用是。(4)、某同学取适量生成物溶于水得50.0mL溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=mol·L-1。14. 氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。(1)、Ⅰ. NaClO中Cl的化合价为 , 有较强的(填氧化、还原)性。(2)、黄色气体ClO2可用于污水杀菌和饮用水净化。①KClO3与SO2在强酸性溶液中反应可制得ClO2 ,SO2被氧化为SO42- , 此反应的离子方程式为。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl- , 该反应过程中氧化剂与还原剂的物质的量之比为。
 (3)、Ⅱ.某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(3)、Ⅱ.某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式;
(4)、C装置的作用是。(5)、此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。①温度较高时氯气与消石灰反应生成Ca(ClO3)2 , 为避免此副反应的发生,可采取的措施是。②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进。