高中化学人教版(新课标)必修1 第四章第一节 无机非金属材料的主角—硅
试卷更新日期:2020-10-30 类型:同步测试
一、单选题
-
1. 硅及其化合物应用广泛,下列叙述正确的是( )A、硅酸钠可用于制备木材防火剂 B、水晶项链是硅酸盐制品 C、光导纤维的主要成分是晶体硅 D、硅在地壳中主要以游离态形式存在2. 下列说法正确的是( )A、硅材料广泛应用于光纤通讯 B、工艺师利用盐酸刻蚀石英制作艺术品 C、水晶项链和餐桌上的瓷盘都是硅酸盐制品 D、粗硅制备单晶硅不涉及氧化还原反应3. 化学在生产生活和科学研究中具有重要的作用。下列说法正确的是( )
①石英的主要成分是二氧化硅
②三峡大坝使用了大量水泥,水泥是硅酸盐材料
③太阳能电池的主要成分是硅,太阳能电池在生活中的应用有利于环保、节能
④二氧化硅的熔点高,硬度大,所以可用来制造电子部件和光学器件
⑤水玻璃中含有三种元素,主要用来制备硅胶和木材防火剂
A、①②③ B、②④⑤ C、③④⑤ D、①②③④4. 下列叙述正确的是( )A、SiO2既能和NaOH溶液反应,又能和HF反应,所以SiO2属于两性氧化物 B、因为Na2CO3 +SiO2 Na2 SiO3+CO2↑,所以H2SiO3的酸性比H2CO3强 C、CO2和SiO2都能与C反应 D、CO2和SiO2都是酸性氧化物,所以两者物理性质相似5. 某同学用如图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确.的是( ) A、①和②中发生的反应均为复分解反应 B、向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 C、一段时间后②中有胶冻状物质生成 D、该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸6. 我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下列对晶体硅的有关叙述正确的是( )A、晶体硅的结构与金刚石类似 B、晶体硅的化学性质不活泼,常温下不与任何物质发生反应 C、晶体硅是一种良好的半导体材料,但是它提炼工艺复杂,价格昂贵 D、晶体硅具有金属光泽,故它属于金属材料,可以导电
A、①和②中发生的反应均为复分解反应 B、向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 C、一段时间后②中有胶冻状物质生成 D、该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸6. 我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下列对晶体硅的有关叙述正确的是( )A、晶体硅的结构与金刚石类似 B、晶体硅的化学性质不活泼,常温下不与任何物质发生反应 C、晶体硅是一种良好的半导体材料,但是它提炼工艺复杂,价格昂贵 D、晶体硅具有金属光泽,故它属于金属材料,可以导电二、综合题
-
7. 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。(1)、SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为 , 工艺师常用(填物质名称或化学式)来雕刻玻璃。(2)、用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可作的原料。(3)、工业上常用2C+SiO2 Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是(填化学式,下同),氧化剂是。8. 硅在地壳中的含量较高,硅及其化合物的开发由来已久。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
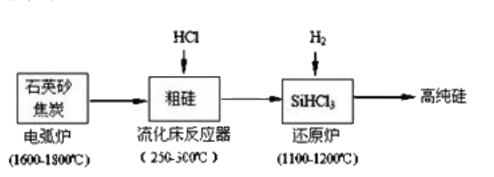 (1)、工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为。(2)、在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_。(3)、有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_;
(1)、工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为。(2)、在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_。(3)、有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_;SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_。
物质
Si
SiCl4
SiHCl3
SiH2Cl2
SiH3Cl
HCl
SiH4
熔点/℃
1410
-70.4
-126.5
-122
-118
-114.2
-185
沸点/℃
2355
57.6
31.8
8.2
-30.4
-84.9
-111.9
(4)、还原炉中发生的化学反应为: 。.(5)、上述工艺生产中循环使用的物质除Si、SiHCl3外, 还有_。9. 按要求填空。(1)、I.现有下列10种物质①熔融的氢氧化钠 ②蔗糖 ③纯净的盐酸 ④金属钠 ⑤硫酸 ⑥二氧化硫 ⑦硫粉 ⑧石膏(CaSO4·2 H2O) ⑨酒精溶液 ⑩液氨属于电解质的有。
(2)、属于非电解质的有。(3)、上述状态下能导电的有。(4)、上述状态下的电解质不能导电的有。(5)、II.Fe(OH)2长时间露置于空气中发生变化的化学方程式为:。偏铝酸钠溶液中通入足量二氧化碳反应的离子方程式为:。
(6)、III.高纯度单晶硅可以按下列方法制备: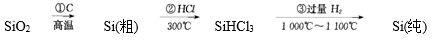
写出步骤①的化学方程式。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是。
10. 已知A是灰黑色、有金属光泽的固体单质。根据如图所示的物质之间的转化关系,回答下列有关问题。 (少量)(1)、写出A,B,C,D的化学式:A , B , C , D。(2)、写出D→A的化学方程式:。(3)、写出B→C的离子方程式:;11. 从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
(少量)(1)、写出A,B,C,D的化学式:A , B , C , D。(2)、写出D→A的化学方程式:。(3)、写出B→C的离子方程式:;11. 从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: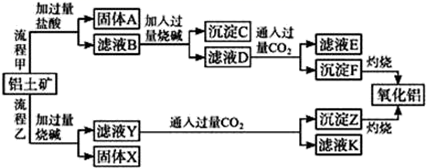
请回答下列问题:
(1)、固体A的主要成分是(写名称);(2)、铝土矿与过量烧碱反应的离子方程式为、;(3)、电解熔融氧化铝可制得两种单质,写出该反应化学方程式;(4)、写出滤液D和过量CO2反应的离子方程式;(5)、指出流程乙的一个缺点是;(6)、氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式。