高中化学人教版(新课标)必修1 第三章测试卷
试卷更新日期:2020-10-30 类型:单元试卷
一、单选题
-
1. 下列金属用途与性质不相对应的是( )A、用铜做电线是由于其导电性良好 B、用钨做灯丝是因为其熔点高 C、铁制品表面镀铬是由于铬硬且不易被氧化 D、性质活泼的金属铝成为应用广泛的金属材料主要是由于铝的延展性好2. 铁与水蒸气反应实验改进前后的装置如图所示:

下列说法错误的是( )
A、将湿棉花改为浸水的尿不湿,酒精灯由单头改为双头,可提供足量的水蒸气 B、用具支试管可将试管口附近冷凝的水导出,避免冷凝水与灼热铁粉接触 C、肥皂水改为吹泡泡水,收集H2效果更好,点燃效果更明显 D、悬挂的磁铁仅能吸引反应铁粉,不能吸引反应产物3. 某溶液中含有HCO3-、SO32-、CO32-、Cl-等 4种阴离子。向其中加入足量的 Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化) ( )A、CO32- B、SO32- C、Cl- D、HCO3-4. 某溶液含有①NO 、②HCO 、③SO 、④CO 、⑤SO 五种阴离子。向其中加入足量的Na2O2固体后,溶液中的离子浓度减小的是(忽略溶液体积变化)( )A、②③ B、① C、④⑤ D、①③④⑤5. 相同质量的铝分别与足量的盐酸和烧碱溶液反应,下列说法正确的是( )A、两个反应的还原剂相同 B、两个反应的氧化剂相同 C、两个反应都生成铝盐和氢气 D、两个反应产生氢气的量不同6. 下列叙述正确的是( )①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3 , Na2O2与CO2发生置换反应生成O2
③Na2O是淡黄色固体,Na2O2是白色固体
④Na2O不稳定,加热能与O2反应生成Na2O2
⑤Na2O2和Na2O焰色反应均为黄色
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤7. 以CO2和Na2O2为原料,制取纯净干燥的O2 , 实验装置如下( )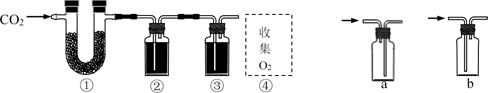
下列说法正确的是
A、装置②中试剂为碱石灰 B、装置③的作用是除去二氧化碳和水 C、.收集氧气应选择装置a D、装置②、③之间应增加盛澄清石灰水的洗气瓶,以确认氧气中二氧化碳已经除尽8. 下列选项所示的物质间转化均能实现的是( )A、 (aq) (g) 漂白粉(s) B、 (aq) (s) (s) C、 (aq) (aq) (aq) D、 (s) (aq) (s)9. 水溶液 X 中只可能溶有 Na+、Mg2+、Al3+、AlO2-、SiO32- 、SO32- 、CO32- 、NO3—中的若干种离子。某同学对该溶液进行了如下实验: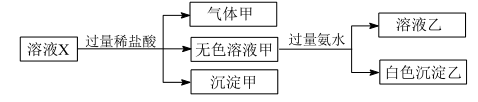
下列判断正确的是( )
A、气体甲一定是纯净物 B、沉淀甲是硅酸和硅酸镁的混合物 C、Na+、AlO2- 和SiO32- 一定存在于溶液X 中 D、CO32- 和NO3- 一定不存在于溶液X 中10. 肯定能得到Al(OH)3的一组物质是( )A、Al片和NaOH溶液 B、Al2O3粉末和H2O C、Al2(SO4)3溶液和NH3·H2O D、AlCl3溶液和NaOH溶液11. 下列物质的转化在给定条件下能实现的是( )①
②
③
④
A、①③ B、①④ C、②③ D、②④12. 某固体混合物 X 可能含有 Fe、Fe2O3、CuO、MnO2、NaCl 和 K2CO3 中的几种,进行了以下实验:①X 溶于足量水中,得到固体Y和弱碱性溶液 Z。
②取固体 Y,加足量浓盐酸,加热,产生无色气体,析出红色固体,得溶液 W。
下列结论正确的是( )
A、X 中一定不存在 Fe2O3、MnO2 B、X 中一定含有 Fe、CuO 和 K2CO3 C、往溶液 Z 中加入 AgNO3 溶液 ,若产生白色沉淀,则Z 中含 NaCl D、取溶液 W, 加少量 NaOH溶液,肯定产生沉淀二、推断题
-
13. A~J是常见的化学物质,转化关系如下图所示。A是生活中的一种调味剂,I是一种用途广泛的金属,常温下C、D、E、F、J皆为气体, H由两种元素构成,摩尔质量为41 g·mol-1。
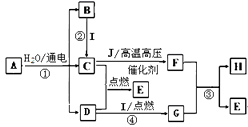 (1)、I的化学式为 , H的化学式为。(2)、写出反应①②③④的化学方程式
(1)、I的化学式为 , H的化学式为。(2)、写出反应①②③④的化学方程式①;②; ③; ④。
14. 已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。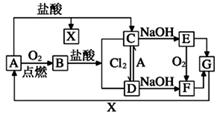 (1)、B的俗名为。(2)、保存C溶液时需加入少量A的原因是 , A与水蒸气反应的化学方程式为 , 该反应类型属于(填基本反应类型)(3)、E生成F可观察到的现象 , 化学方程式为。(4)、写出B→C化学方程式为 , C→D的离子方程式为。
(1)、B的俗名为。(2)、保存C溶液时需加入少量A的原因是 , A与水蒸气反应的化学方程式为 , 该反应类型属于(填基本反应类型)(3)、E生成F可观察到的现象 , 化学方程式为。(4)、写出B→C化学方程式为 , C→D的离子方程式为。三、综合题
-
15. 铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3 , 还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。(1)、Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:

在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□═□Fe(OH)3↓+□Cl-+□_
②检验滤液B中是否还含有铁元素的方法为:
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、(填操作名称)、过滤、洗涤。
(2)、Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。明矾曾经是净水明星,用离子方程式表示其净水原理。
(3)、明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程。16. 某兴趣小组用铝箔制备纳米Al2O3、AlCl3·6H2O及铵明矾晶体(NH4Al(SO4)2•12H2O,摩尔质量为453g•mol-1),具体流程如图:
已知:a.AlCl3·6H2O易溶于水、乙醇及乙醚;
b.铵明矾晶体无色、透明,可溶于水、不溶于乙醇。120℃时失去结晶水,280℃以上分解。
请回答:
(1)、步骤Ⅰ的离子方程式为。(2)、下列操作或描述正确的是_____。A、步骤IV制备铵明矾利用了物质的溶解度差异 B、步骤III灼烧时需将氢氧化铝放在蒸发皿里用高温炉灼烧至恒重 C、步骤II生成的固体可用抽滤法分离,为加快过滤速度,可用玻璃棒轻轻搅拌 D、步骤IV中可以选择乙醇洗涤晶体,如果在常压下快速干燥,温度选择低于120℃(3)、由溶液A制备AlCl3·6H2O的过程中要通入HCl气体,其作用是(写两条)。(4)、步骤V抽滤时不能用滤纸,原因是。若用如图装置图进行抽滤,则抽滤结束时应进行的操作是。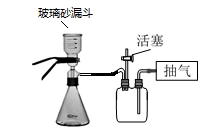 (5)、用电子天平称取2.760g的铵明矾粗产品,用水溶解后取相同体积的两份溶液。第一份用EDTA滴定法测得n(Al3+)为0.002900mol;第二份用BaCl2溶液滴定法测得n(SO42-)为0.006300mol。则该试样中铵明矾的纯度为。17. 铝和铝合金是一类重要的金属材料。回答下列问题:(1)、除去镁粉中混有少量铝粉,应加入的试剂为 , 然后经过滤、洗涤、干燥。(2)、等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 H2在同温同压下的体积之比是。(3)、现有 AlCl3和 MgSO4混合溶液,向其中不断加入 NaOH 溶液,得到沉淀的物质的量与加入 NaOH 溶液的体积之间的关系如图所示。原溶液中 Cl- 与SO42- 的物质的量之比为。
(5)、用电子天平称取2.760g的铵明矾粗产品,用水溶解后取相同体积的两份溶液。第一份用EDTA滴定法测得n(Al3+)为0.002900mol;第二份用BaCl2溶液滴定法测得n(SO42-)为0.006300mol。则该试样中铵明矾的纯度为。17. 铝和铝合金是一类重要的金属材料。回答下列问题:(1)、除去镁粉中混有少量铝粉,应加入的试剂为 , 然后经过滤、洗涤、干燥。(2)、等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 H2在同温同压下的体积之比是。(3)、现有 AlCl3和 MgSO4混合溶液,向其中不断加入 NaOH 溶液,得到沉淀的物质的量与加入 NaOH 溶液的体积之间的关系如图所示。原溶液中 Cl- 与SO42- 的物质的量之比为。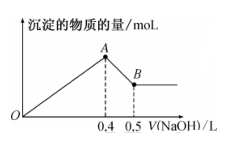 (4)、某同学在实验室用铝土矿(含有 Al2O3和SiO2 , 不考虑其他杂质)制取金属铝的流程如下:
(4)、某同学在实验室用铝土矿(含有 Al2O3和SiO2 , 不考虑其他杂质)制取金属铝的流程如下: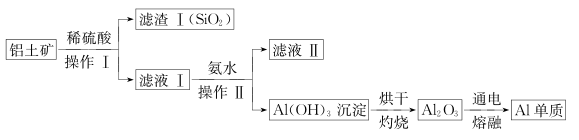 ①Al2O3与稀硫酸反应的离子方程式为 。
①Al2O3与稀硫酸反应的离子方程式为 。②滤液II中溶质的用途之一是 。
③电解熔融的 Al2O3除得到金属铝之外,还可得到的气体产物是 (填化学式)。工业上在电解熔融的 Al2O3 时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低 Al2O3的熔点。冰晶石在物质的分类中属于(填字母)。
a.酸 b.碱 c.盐 d.氧化物
18. 金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题.(1)、含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是____。A、铝合金 B、青铜 C、镁合金 D、钢(2)、FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为。(3)、某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是(填字母)A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)、Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)3晶体的方法如下: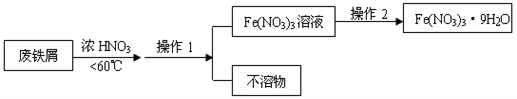
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为。
②磁性氧化铁的化学式为 , 试写出Fe2O3与硝酸反应的离子方程式。
③操作1的名称为 , 操作2的步骤为: , 过滤,洗涤。
19. 某化学课外活动小组利用废铁屑(含少量硫等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],并设计了如图所示的装置(夹持仪器略去)。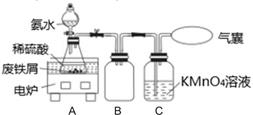
称取一定量的表面除去油污的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)、相比通常铁与稀硫酸生成氢气的条件,在实验中选择50~60℃热水浴的原因是;锥形瓶中溶液冷却至室温后再加入氨水的原因。(2)、C瓶中KMnO4溶液的作用是。(3)、若要确保获得浅绿色悬浊液,下列符合实验要求的是 (填字母)。a.保持铁屑过量
b.控制溶液呈强碱性
c.将稀硫酸改为浓硫酸
(4)、莫尔盐是一种重要化学药品,较绿矾稳定,不易被空气氧化,是化学分析中常用的基准物之一。其组成可用(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O表示。一定条件下,(NH4)2Fe(SO4)2发生分解:4(NH4)2Fe(SO4)2=2Fe2O3+5SO2↑+3SO3↑+N2↑+6NH3↑+7H2O下列叙述正确的是。a反应生成amolN2时,转移电子的物质的量为6amol
b该反应的还原产物是硫的两种氧化物
c有amol电子转移时,生成SO2的物质的量为0.1amol
d将气体产物用足量BaCl2溶液吸收,只得到一种沉淀物
(5)、实验探究:影响溶液中Fe2+稳定性的因素。配制0.8mol/L的FeSO4溶液(pH=4.5)和0.8mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2mL上述溶液于两支试管中,刚开始两种溶液都呈浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,过了一会儿观察可见(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料)
沉淀
Fe(OH)2
Fe(OH)3
开始沉淀pH
7.6
2.7
完全沉淀pH
9.6
3.7
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其它条件相同时,在一定pH范围内,溶液pH越小Fe2+稳定性越好。
假设3:。
(6)、称取ag所制得的硫酸亚铁铵晶体,用加热煮沸的蒸馏水溶解,配成250mL溶液,取出25mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为(用含c、V、a的代数式表示)。