高中化学人教版(新课标)必修1 第三章第二节 几种重要的金属化合物
试卷更新日期:2020-10-30 类型:同步测试
一、单选题
-
1. 下列关于金属及其化合物说法错误的是( )A、氧化铝用作耐火材料 B、小苏打用于食品膨松剂 C、目前用量最大的合金是铝合金 D、过氧化钠可作供氧剂2. 下列有关焰色试验说法中正确的是( )A、用光洁的铂丝蘸取某无色溶液,灼烧时观察到黄色火焰,说明一定含Na+ , 不含K+ B、焰色试验中需用盐酸洗净铂丝 C、焰色试验均应透过蓝色钴玻璃观察 D、只有金属单质灼烧时火焰才有颜色3. 高铜酸钾化学式KCuO2 , 为黑色粉末状固体,在酸性和中性条件下不稳定。下列说法错误的是( )A、KCuO2的水溶液呈碱性 B、可将KCuO2改写成K2O2∙2CuO或K2O∙Cu2O3的形式 C、KCuO2具有强氧化性 D、已知KCuO2高温时会分解生成K2CuO2、CuO和一种气体,该气体为O24. 既能与稀盐酸反应,又能与NaOH溶液反应的化合物是:( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A、仅①②③ B、仅①④ C、仅②③④ D、①②③④5. X是中学化学常见的单质,Y、Z为化合物。它们有如图所示的转化关系(部分产物及反应条件省略)。下列判断正确的是( )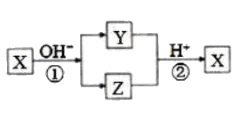 A、X可能是金属,也可能是非金属 B、X、Y、Z含有一种相同的元素 C、Y、Z的水溶液一定都呈碱性 D、反应①②不一定都是氧化还原反应6. 下图为A、B、C、D、E之间的相互转换关系A为一种气态单质,D是一种红棕色气体。下列说法正确的是( )
A、X可能是金属,也可能是非金属 B、X、Y、Z含有一种相同的元素 C、Y、Z的水溶液一定都呈碱性 D、反应①②不一定都是氧化还原反应6. 下图为A、B、C、D、E之间的相互转换关系A为一种气态单质,D是一种红棕色气体。下列说法正确的是( ) A、C 物质和O2必须在催化剂表面才能反应生成D B、Cu 和E 溶液反应体现了E 的强氧化性和酸性 C、可用NaOH 溶液除去混在D物质中的少量B 物质 D、B 生成C 的反应中,氧化剂与还原剂之比为4: 57. 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
A、C 物质和O2必须在催化剂表面才能反应生成D B、Cu 和E 溶液反应体现了E 的强氧化性和酸性 C、可用NaOH 溶液除去混在D物质中的少量B 物质 D、B 生成C 的反应中,氧化剂与还原剂之比为4: 57. 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( ) A、若A是铁,则E可能为稀硝酸 B、若A是AlCl3溶液,E可能是氨水 C、若A是CuO,E是碳,则B为CO D、若A是NaOH溶液,E是CO2 , 则B为NaHCO38. 确认化学反应先后顺序有利于解决问题,下列反应先后顺序判断正确的是( )A、在各1mol的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ B、在各2mol的Ba(OH)2、KOH的溶液中通入CO2:KOH,Ba(OH)2、BaCO3 C、在各 2mol的 Fe2+、Ag+、Cu2+、H+的溶液中加入 Zn:Ag+、Cu2+、H+、Fe2+ D、在各1mol 的 AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-9. 黄色固体X,可能含有漂白粉、FeSO4、Fe2(SO4)3、CuCl2、KI之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是( )A、X中一定含有漂白粉,一定不含KI B、X中一定含有CuCl2 , FeSO4和Fe2(SO4)3 C、用H2SO4酸化溶液Z,若有黄绿色气体放出,说明X中含有CuCl2 D、Y是Fe(OH)2、Fe(OH)3和Cu(OH)2的混合物10. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、
A、若A是铁,则E可能为稀硝酸 B、若A是AlCl3溶液,E可能是氨水 C、若A是CuO,E是碳,则B为CO D、若A是NaOH溶液,E是CO2 , 则B为NaHCO38. 确认化学反应先后顺序有利于解决问题,下列反应先后顺序判断正确的是( )A、在各1mol的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ B、在各2mol的Ba(OH)2、KOH的溶液中通入CO2:KOH,Ba(OH)2、BaCO3 C、在各 2mol的 Fe2+、Ag+、Cu2+、H+的溶液中加入 Zn:Ag+、Cu2+、H+、Fe2+ D、在各1mol 的 AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-9. 黄色固体X,可能含有漂白粉、FeSO4、Fe2(SO4)3、CuCl2、KI之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是( )A、X中一定含有漂白粉,一定不含KI B、X中一定含有CuCl2 , FeSO4和Fe2(SO4)3 C、用H2SO4酸化溶液Z,若有黄绿色气体放出,说明X中含有CuCl2 D、Y是Fe(OH)2、Fe(OH)3和Cu(OH)2的混合物10. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、
B、 C、Fe FeCl2 Fe(OH)2
D、
C、Fe FeCl2 Fe(OH)2
D、 11. 某固体混合物X,可能含有K2SO3、KAlO2、FeCl3、Na2CO3中的一种或几种。为确定该固体粉末的成分,现取X进行如下实验:
11. 某固体混合物X,可能含有K2SO3、KAlO2、FeCl3、Na2CO3中的一种或几种。为确定该固体粉末的成分,现取X进行如下实验:①X与足量稀硝酸反应,得到气体1和溶液2
②溶液2中滴加足量的氨水,得到有色沉淀3
下列说法正确的是( )
A、气体1可能为SO2和CO2的混合物 B、沉淀3可能为Fe(OH)3和Al(OH)3的混合物 C、固体粉末X中一定有FeCl3、Na2CO3 , 可能有KAlO2 D、往溶液2中加入Cu粉,若溶解,说明X中含有FeCl3固体粉末12. 给定条件下,下列选项中所示的物质间转化均能一步实现的是( )A、粗硅 SiCl4 Si B、Mg(OH)2 MgCl2(aq) Mg C、Fe2O3 FeCl3(aq) 无水FeCl3 D、AgNO3(aq) [Ag(NH3)2]OH(aq) Ag二、实验探究题
-
13. 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是一种稳定的还原剂,常用作分析化学中的滴定剂。某课题组采用下列方案制备该晶体,并对其热稳定性进行了如下实验。(1)、Ⅰ.硫酸亚铁铵晶体的制备:
铁粉 FeSO4溶液 结晶 硫酸亚铁铵晶体
硫酸浓度过大,反应过快同时会使FeSO4溶液中混有(填离子符号)。
(2)、利用FeSO4溶液与(NH4)2SO4晶体制备该晶体的化学方程式。(3)、Ⅱ.硫酸亚铁铵晶体的热分解产物探究:该小组同学选用如图所示部分装置进行实验(夹持装备略)。查阅资料:隔绝空气加热至500℃硫酸亚铁铵能完全分解,产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
点燃A处的酒精灯之前,先打开弹簧夹,通一段时间N2 , 其目的是。
(4)、选用上述部分必要的装置完成下列相应实验,填写横线上的内容。检验可能产物
装置连接顺序
装置作用
实验现象
实验结论
H2O、NH3
ACBGD
①B的作用
②C中;
D中。
有H2O、NH3
SO2、SO3
③
④E中HCl的作用
E中没有明显现象,F中溶液褪色
⑤
(5)、为证明热分解完全后残留的固体仅为Fe2O3 , 而不含FeO或Fe3O4 , 需要选用的试剂有(选下列字母);简述利用所选试剂进行实验证明的方案。A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.H2O2溶液 E.K3[Fe(CN)6]溶液
14. 高铁酸钾(K2FeO4)为高效净水剂,紫色固体,易溶于水,微溶于KOH溶液;具有强氧化性,在酸性溶液中完全、快速产生O2 , 在碱性溶液中较稳定。某实验小组制备高铁酸钾并探究其性质。(1)、制备K2FeO4(夹持装置略)
①装置B中所用试剂为。
②C中得到紫色固体和溶液,C中发生的主要反应为(用化学方程式表示)。
(2)、探究K2FeO4的性质①将K2FeO4溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明酸性条件下 与 氧化性的强弱关系,请说明理由:。
②取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2 , 某同学设计了以下方案:取少量a,滴加KSCN溶液至过量,溶液呈红色。该方案并不完善,因为溶液变红的原因可能是 , (用离子方程式表示),重新设计实验方案,证明是K2FeO4氧化了Cl-而产生Cl2:将装置C中混合物过滤,。[实验中必须使用的试剂:盐酸、KOH溶液、淀粉碘化钾试纸]
三、综合题
-
15. 将铁粉、铜粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(容器不参与反应),试判断下列情况溶液中存在的金属离子和金属单质。(1)、若铁粉有剩余,则容器不可能有。(2)、若CuCl2有剩余,则容器中一定有可能有。(3)、若FeCl3和CuCl2都有剩余,则容器中不可能有 , 一定有。(4)、FeCl3和Fe粉反应时,氧化产物与还原产物的物质的量之比为。16. 下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。
 (1)、推断(写化学式):A.B. G。(2)、请写出反应D→F的化学方程式:。(3)、检验F中金属阳离子的常用试剂是(填物质的化学式);现象是。(4)、写出C与过量氢氧化钠溶液反应的离子方程式_。(5)、若向D溶液中滴加氢氧化钠溶液,现象是:17. 由三种元素组成的化合物A,按如图流程进行实验:
(1)、推断(写化学式):A.B. G。(2)、请写出反应D→F的化学方程式:。(3)、检验F中金属阳离子的常用试剂是(填物质的化学式);现象是。(4)、写出C与过量氢氧化钠溶液反应的离子方程式_。(5)、若向D溶液中滴加氢氧化钠溶液,现象是:17. 由三种元素组成的化合物A,按如图流程进行实验:
已知:①气体B为纯净物。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)、组成A的三种元素是 , A的化学式是。(2)、固体A与足量稀盐酸反应的化学方程式是。(3)、气体B与足量CuO在加热条件下反应,请写出一个可能的化学方程式。