高中化学人教版(新课标)必修1 第三章第一节 金属的化学性质
试卷更新日期:2020-10-30 类型:同步测试
一、单选题
-
1. 下列有关物质的性质与用途具有对应关系的是 ( )A、Al2O3具有两性,可用作耐高温材料 B、NaHCO3溶液呈碱性,可用于制备纯碱 C、铝具有良好导热性,可用作贮运浓硝酸 D、FeCl3溶液具有氧化性,可用作蚀刻铜电路板2. 下列物质中,不能与金属钠反应的是( )A、氧气 B、水 C、盐酸 D、煤油3. 常温下,铝条与下列溶液不能持续反应的是( )A、氢氧化钠溶液 B、浓硫酸 C、稀硫酸 D、硫酸铜溶液4. 下列金属单质,不能在特定条件下和水反应的是( )A、镁 B、钠 C、铁 D、银5. 根据如图实验所得推论不合理的是( )
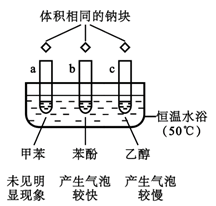
已知:苯酚的熔点为 43℃
A、试管 a 中钠沉在底部,说明密度:甲苯<钠 B、试管 b、c 中生成的气体均有 H2 C、苯酚中羟基的活性比乙醇中羟基的活性强 D、羟基对苯环的影响使苯环上羟基邻、对位的C—H 键易于断裂6. 28g CO气体在1mol的氧气中燃烧后,所得的气体通过足量Na2O2固体中充分反应后,下列说法不正确的是( )A、CO与氧气反应,只消耗了0.5mol氧气 B、充分反应后Na2O2固体质量增加了28 g C、通过以上两步反应后余下氧气物质的量为0.5mol D、若2gH2替代 28g的CO发生上述反应,则Na2O2固体质量增加了2g7. 下列有关钠的叙述正确的是( )A、2.3 g钠与97.7 g水反应后溶液中溶质的质量分数等于4% B、钠跟CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出了金属铜 C、因为钠比较活泼,故将钠放入FeCl3溶液中有红褐色沉淀生成 D、钠在空气中的缓慢氧化与其在空气中点燃的产物都一样8. 下列关于Na2O和Na2O2的叙述正确的是( )A、Na2O与Na2O2均可与水反应产生氧气 B、Na2O与Na2O2分别与CO2反应的产物完全相同 C、Na2O与Na2O2均为碱性氧化物 D、在呼吸面具中,Na2O2常做供氧剂,而Na2O不能9. 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )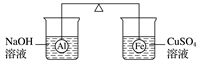 A、铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 B、铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉 C、反应后去掉两烧杯,杠杆仍平衡 D、右边球上出现红色,左边溶液的c(OH-)增大10. 有关Al与NaOH溶液反应的说法中,正确的是( )A、还原产物是H2 , 且由H2O还原所得的H2与由NaOH还原所得的H2物质的量之比为2∶1 B、Al是还原剂,NaOH既不是氧化剂也不是还原剂 C、此反应说明铝具有两性 D、此反应中,只有H2O是氧化剂,3molNaOH参加反应生成2molH211. 用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
A、铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 B、铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉 C、反应后去掉两烧杯,杠杆仍平衡 D、右边球上出现红色,左边溶液的c(OH-)增大10. 有关Al与NaOH溶液反应的说法中,正确的是( )A、还原产物是H2 , 且由H2O还原所得的H2与由NaOH还原所得的H2物质的量之比为2∶1 B、Al是还原剂,NaOH既不是氧化剂也不是还原剂 C、此反应说明铝具有两性 D、此反应中,只有H2O是氧化剂,3molNaOH参加反应生成2molH211. 用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )①加盐酸溶解 ②加足量烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A、①⑥⑤③ B、②③④③ C、②③⑤③ D、①③⑤③12. 铁粉与水蒸气在一定条件下可以反应,下列说法错误的是( ) A、用火柴点燃前需要检验气体的纯度 B、火焰的颜色为淡蓝色 C、反应后试管中生成红棕色固体 D、168g铁粉与足量水蒸气完全反应时,转移8mol电子
A、用火柴点燃前需要检验气体的纯度 B、火焰的颜色为淡蓝色 C、反应后试管中生成红棕色固体 D、168g铁粉与足量水蒸气完全反应时,转移8mol电子二、综合题
-
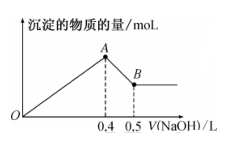
13. 铝和铝合金是一类重要的金属材料。回答下列问题:(1)、除去镁粉中混有少量铝粉,应加入的试剂为 , 然后经过滤、洗涤、干燥。(2)、等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 H2在同温同压下的体积之比是。(3)、现有 AlCl3和 MgSO4混合溶液,向其中不断加入 NaOH 溶液,得到沉淀的物质的量与加入 NaOH 溶液的体积之间的关系如图所示。原溶液中 Cl- 与SO42- 的物质的量之比为。
 (4)、某同学在实验室用铝土矿(含有 Al2O3和SiO2 , 不考虑其他杂质)制取金属铝的流程如下:
(4)、某同学在实验室用铝土矿(含有 Al2O3和SiO2 , 不考虑其他杂质)制取金属铝的流程如下: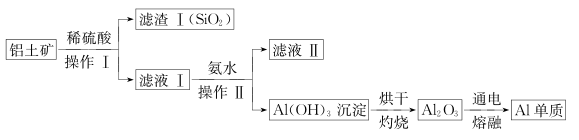 ①Al2O3与稀硫酸反应的离子方程式为 。
①Al2O3与稀硫酸反应的离子方程式为 。②滤液II中溶质的用途之一是 。
③电解熔融的 Al2O3除得到金属铝之外,还可得到的气体产物是 (填化学式)。工业上在电解熔融的 Al2O3 时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低 Al2O3的熔点。冰晶石在物质的分类中属于(填字母)。
a.酸 b.碱 c.盐 d.氧化物
14. 研究钠及其化合物有重要意义。(1)、NaOH是实验室中最常用的试剂之一。实验室配制0.5 mol/L的氢氧化钠溶液500 mL,根据配制溶液的过程,回答问题:①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是。
②实验中需用托盘天平(带砝码)称量NaOH固体g。
(2)、Na2O2可作为呼吸面具和潜水艇里氧气的来源。Na2O2作为供氧剂时可能发生的反应有、。(3)、过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经变质:(说明操作、现象和结论)。(4)、NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。①已知NaNO2能发生如下反应: 2 NaNO2+4HI=2NO↑+I2+2NaI+2H2O
上述反应中,标准状况下,每生成2.24LNO气体,转移电子的物质的量为mol,参加反应的HI的物质的量是mol。
②实验室要鉴别NaNO2和NaCl两种固体,可选用的试剂是(填序号)。
A. HI溶液
B. NaOH溶液
C.酸化KI溶液和淀粉溶液
D. Ba(NO3)2溶液
15. 如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的水蒸气,并靠近火焰点燃。 (1)、写出该反应的化学方程式 ,四氧化三铁是(填“氧化产物”还是“还原产物”) 。(2)、加热烧瓶的作用是。(3)、烧瓶底部放了几片碎瓷片,其作用是。16. 从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
(1)、写出该反应的化学方程式 ,四氧化三铁是(填“氧化产物”还是“还原产物”) 。(2)、加热烧瓶的作用是。(3)、烧瓶底部放了几片碎瓷片,其作用是。16. 从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: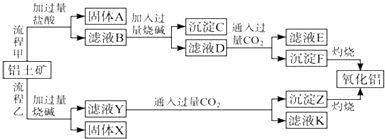
请回答下列问题:
(1)、流程甲加入盐酸后生成Al3+的离子方程式为 .(2)、流程乙加入烧碱后生成SiO32﹣的离子方程式为 .(3)、验证滤液B含Fe3+ , 可取少量滤液并加入(填试剂名称).(4)、滤液D产生沉淀F的离子方程式为 .(5)、滤液E、K中溶质的主要成分是(填化学式),写出该溶质的一种用途