浙江省杭州市余杭区2020-2021学年九年级上学期科学10月质量检测试卷
试卷更新日期:2020-10-30 类型:月考试卷
一、选择题(本大题共60分,每小题3分。每小题只有一个选项符合题意)
-
1. 判断镁条燃烧是化学变化的主要依据是( )A、发出耀眼的白光 B、放出大量的热 C、生成白色固体氧化镁 D、颜色改变2. 如图是物质X溶于水中发生电离的微观示意图,其中能说明X是一种酸的是( )A、
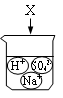 B、
B、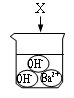 C、
C、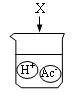 D、
D、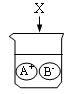 3. 打开浓盐酸试剂瓶,发现瓶口有“白雾"出现。已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-)。下列实验能证明“白雾”中含有氢离子的是( )
3. 打开浓盐酸试剂瓶,发现瓶口有“白雾"出现。已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-)。下列实验能证明“白雾”中含有氢离子的是( ) A、①③ B、②④ C、①②④ D、①③④4. 盐酸先生闯迷宫(如图),请你帮他选择行进路线(不发生化学反应)( )
A、①③ B、②④ C、①②④ D、①③④4. 盐酸先生闯迷宫(如图),请你帮他选择行进路线(不发生化学反应)( ) A、A B、B C、C D、D5. 下列关于硫酸的认识,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO3等非金属氧化物反应 C、用途:可用于实验室制备CuSO4等硫酸盐 D、生产:含硫酸废水用CaCl处理后直接排放6. 若利用碱的性质进行下列实验,不能达到相应目的的是( )A、分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液 B、分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固停 C、分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液 D、分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体7. 实验室中一瓶浓硫酸敞口放置一定时间,下列四幅图,能正确反映其变化关系的是( )A、
A、A B、B C、C D、D5. 下列关于硫酸的认识,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO3等非金属氧化物反应 C、用途:可用于实验室制备CuSO4等硫酸盐 D、生产:含硫酸废水用CaCl处理后直接排放6. 若利用碱的性质进行下列实验,不能达到相应目的的是( )A、分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液 B、分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固停 C、分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液 D、分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体7. 实验室中一瓶浓硫酸敞口放置一定时间,下列四幅图,能正确反映其变化关系的是( )A、 B、
B、 C、
C、 D、
D、 8. 某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示。下列说法正确的是( )
8. 某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示。下列说法正确的是( ) A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应9. 某同学将一定量的Na2CO3与Ba(OH)2溶液混合,要想检验反应后Ba(OH)2是否过量,应选用的试剂是( )A、酚酞 B、CuCl2溶液 C、Na2CO3溶液 D、NaCl溶液10. 对一瓶已变质的NaOH溶液进行如下实验,其中实验方案能达到实验目的是( )
A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应9. 某同学将一定量的Na2CO3与Ba(OH)2溶液混合,要想检验反应后Ba(OH)2是否过量,应选用的试剂是( )A、酚酞 B、CuCl2溶液 C、Na2CO3溶液 D、NaCl溶液10. 对一瓶已变质的NaOH溶液进行如下实验,其中实验方案能达到实验目的是( )选项
实验目的
实验方案
A
证明溶液中存在Na2CO3
取样,滴加无色酚酞溶液
B
除去溶液中的Na2CO3
加入一定量的CaCl2溶液,然后过滤
C
证明溶液部分变质
取样,加入过量呈中性的BaCl2溶液,振荡后滴加无色酚酞溶液
D
测溶液的pH
用玻璃棒蘸取少量溶液滴在湿润的pH试纸上,与标准比色卡对比
A、A B、B C、C D、D11. “部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,下表是截取溶解性表中的一部分,有关①处物质的说法不正确的是( )阴离子
阳离子
OH-
Cl-
…
…
…
Fe2+
不
①
…
…
…
A、①处物质的化学式是FeCl2 B、①处物质的名称是氯化铁 C、①处物质可溶于水 D、①处物质类别属于盐12. 现有盐酸和BaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH变化如图所示。则X可能是( ) A、稀硫酸 B、纯碱溶液 C、食盐溶液 D、氢氧化钠溶液13. 为鉴别氯化钠、氢氧化钠、碳酸钠和硫酸钠四种物质的溶液,设计如下实验:
A、稀硫酸 B、纯碱溶液 C、食盐溶液 D、氢氧化钠溶液13. 为鉴别氯化钠、氢氧化钠、碳酸钠和硫酸钠四种物质的溶液,设计如下实验:
下面对试剂@、试剂②和试剂③的选择,合理的是( )
A、①酚酞②稀盐酸③氯化钡 B、①酚酞②稀盐酸③稀盐酸 C、①石蕊②氯化钡③稀盐酸 D、①石蕊②氯化钡③碳酸钠14. 小金完成了图示实验①②③,下列判断正确的是( )
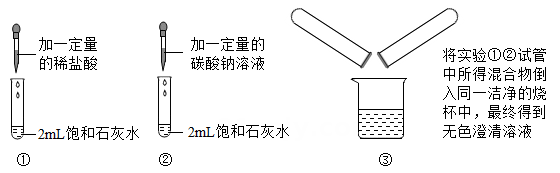 A、实验①中石灰水有剩余 B、实验②中有气泡产生 C、实验③中没有明显现象 D、实验③所得溶液中一定含CaCl2和NaCl15. 小金取8.0g干燥的氢氧化钠固体于敞口的锥形瓶中,观察到氢氧化钠固体发生潮解,一段时间后测得锥形瓶内物质质量为10.0g。为进一步探究上述现象的成因,小金立即用如图装置进行实验:将试剂X逐滴滴入锥形瓶中,直至不再产生气泡为止,测得装置前后质量减少了1.1g。(不考虑滴加液体体积、气体密度变化和结晶水的生成)。下列推断正确的是( )
A、实验①中石灰水有剩余 B、实验②中有气泡产生 C、实验③中没有明显现象 D、实验③所得溶液中一定含CaCl2和NaCl15. 小金取8.0g干燥的氢氧化钠固体于敞口的锥形瓶中,观察到氢氧化钠固体发生潮解,一段时间后测得锥形瓶内物质质量为10.0g。为进一步探究上述现象的成因,小金立即用如图装置进行实验:将试剂X逐滴滴入锥形瓶中,直至不再产生气泡为止,测得装置前后质量减少了1.1g。(不考虑滴加液体体积、气体密度变化和结晶水的生成)。下列推断正确的是( )
①试剂X可以是稀硫酸
②固体Y可以是生石灰
③滴加试剂X前锥形瓶内水的质量为0.9g
④若没有球形干燥管,测得氢氧化钠固体从空气中吸收水的质量会偏小
A、①③ B、①④ C、②③ D、②④16. 向含CuCl2和HCl的100g混合溶液中,逐滴加溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图[仅考虑沉淀为Cu(OH)2则下列说法不正确的是( ) A、整个反应过程中,氯离子个数不变 B、M点溶液中的溶质只有一种 C、M点溶液比P点溶液中氯化钠的质量分数大 D、沉淀完全时,m1的数值为8017. 将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
A、整个反应过程中,氯离子个数不变 B、M点溶液中的溶质只有一种 C、M点溶液比P点溶液中氯化钠的质量分数大 D、沉淀完全时,m1的数值为8017. 将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( ) A、N点时,所得溶液的pH=7 B、Q点时,所得溶液中的溶质只含有BaCl2 C、O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O D、P至Q段发生反应的化学方程式为Ba(OH)2+2HICl=BaCl2+2H2O18. 下列除去杂质的方法中正确的是( )
A、N点时,所得溶液的pH=7 B、Q点时,所得溶液中的溶质只含有BaCl2 C、O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O D、P至Q段发生反应的化学方程式为Ba(OH)2+2HICl=BaCl2+2H2O18. 下列除去杂质的方法中正确的是( )选项
物质
杂质
除杂质的方法
A
CaCl2溶液
稀盐酸
加过量碳酸钙,过滤
B
K2CO3溶液
KCl
加适量稀盐酸
C
CaO
CaCO3
加水,过滤
D
NaCl溶液
Na2CO3
加适量硝酸钙溶液,过滤
A、A B、B C、C D、D19. “碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用NaOH溶液来"捕捉"CO2 , 过程如图所示(部分条件及物质未标出)。下列说法正确的是( ) A、该方法的优点是没有能耗 B、该方法可减少碳排放 C、整个过程中,只有一种物质可以循环利用 D、“反应、分离”中,分离物质的基本操作是蒸发、结晶20. 某些金属氢化物与水反应可生成碱和氢气,如:NaH+H2O=NaOH+H2↑,则CaH2与足量Na2CO3溶液之间发生反应的产物是( )A、CaCO3、NaOH和H2 B、Ca(OH)2和H2 C、NaOH和Ca(OH)2 D、Ca(OH)2、CaCO3和H2
A、该方法的优点是没有能耗 B、该方法可减少碳排放 C、整个过程中,只有一种物质可以循环利用 D、“反应、分离”中,分离物质的基本操作是蒸发、结晶20. 某些金属氢化物与水反应可生成碱和氢气,如:NaH+H2O=NaOH+H2↑,则CaH2与足量Na2CO3溶液之间发生反应的产物是( )A、CaCO3、NaOH和H2 B、Ca(OH)2和H2 C、NaOH和Ca(OH)2 D、Ca(OH)2、CaCO3和H2二、填空题(每空2分,共50分)
-
21.(1)、用洁净的玻璃棒蘸取浓硫酸,涂在滤纸上,滤纸很快变黑,该实验说明浓硫酸具有性。(2)、如图,用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒紫色石蕊试液,然后挂在铁架台上; 另取一只盛有浓盐酸的烧杯放在纸蝴蝶的下方,过一会儿,发现纸蝴蝶的颜色逐渐变成红色。该实验说明浓盐酸具有性。
 22. 厨房里有两瓶白色固体,分别为食盐(NaCl) 和纯碱(Na2CO3)。(1)、可用于腌制肉类和蔬菜,使食物不易腐败的是。(2)、为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
22. 厨房里有两瓶白色固体,分别为食盐(NaCl) 和纯碱(Na2CO3)。(1)、可用于腌制肉类和蔬菜,使食物不易腐败的是。(2)、为鉴别这两种物质,某同学取少量白色固体,进行如下实验。方案一:分别滴加少量食醋,有气泡产生的是。
方案二:加水溶解,分别滴加溶液,有沉淀产生的是纯碱。
23. 学习了酸和碱的性质之后,林林在实验室进行了下列实验:(1)、取少量稀盐酸 与一定质量的氢氧化钠溶液充分混合后得到混合溶液A1向A1中加入碳酸钠溶液,有气泡产生。说明A1显性:(2)、另取少量稀盐酸与一定质量的氢氧化钠溶 波充分混合后得到混合溶液A2 , 向A2中滴加无色酚酞试液,溶液变红。说明A2呈性;(3)、酸碱指示剂可以指示溶液的酸碱性,pH可以表示溶液的。综合(1)和2可知,A1的pHA2的pH(填“>”、“<"或“=”)。24. 世界是由物质组成的,请选用下列物质的序号填空:A.干冰:B.酒精:C.消石灰:D.碳酸钠;
(1)、用作中和酸性土壤的是;(2)、用于人工降雨的是;(3)、"侯氏联合制碱法”中的“碱”是。25. 化学使世界变得绚丽多彩。如图所示是物质之间发生化学反应的颜色变化。 (1)、请你在②③处各填入一种物质。
(1)、请你在②③处各填入一种物质。②是;③是。
(2)、根据图可以总结出稀硫酸的五个化学性质。请你写出由①得出的稀硫酸的化学性质: 。(3)、若④所表示的物质是盐,请你写出一个符合④的化学方程式:。26. 归纳总结是学习科学的一种方法。请结合小明同学对碱的四点化学性质的归纳图回答下列问题(箭头上方的物质是指与碱反应的物质)。 (1)、碱溶液有相似的化学性质,是因为碱溶液中都含有 (填化学符号)。(2)、请帮小明补充完整性质3箭头上方的反应物质是 (选填“酸”、“碱”或“盐”)。(3)、氢氧化钠暴露在空气中发生变质的原因:。27. 根据图回答问题:
(1)、碱溶液有相似的化学性质,是因为碱溶液中都含有 (填化学符号)。(2)、请帮小明补充完整性质3箭头上方的反应物质是 (选填“酸”、“碱”或“盐”)。(3)、氢氧化钠暴露在空气中发生变质的原因:。27. 根据图回答问题:
 (1)、加入稀盐酸至过量能观察到的现象是;(2)、反应中,数目减少的离子是(填离子符号);(3)、验证反应后溶液中稀盐酸有剩余,下列操作可行的是 。A、取样,加入CuO粉末 B、取样,滴加NaOH溶液 C、取样,加入CaCO3粉末 D、取样,滴加AgNO3溶液28. 小明在化学晚会上观看了“瓶吞鸡蛋”的魔术[如图(1)所示],看到鸡蛋被吞进瓶内。该反应的化学方程式是。
(1)、加入稀盐酸至过量能观察到的现象是;(2)、反应中,数目减少的离子是(填离子符号);(3)、验证反应后溶液中稀盐酸有剩余,下列操作可行的是 。A、取样,加入CuO粉末 B、取样,滴加NaOH溶液 C、取样,加入CaCO3粉末 D、取样,滴加AgNO3溶液28. 小明在化学晚会上观看了“瓶吞鸡蛋”的魔术[如图(1)所示],看到鸡蛋被吞进瓶内。该反应的化学方程式是。
小明思考:瓶能吞蛋,能不能吐蛋呢?他进行了如图(2)所示的实验,结果鸡蛋吐了出来。他加入的试剂P是 , 该反应的化学方程式是 。
三、实验探究题(共34分)
-
29. 学习氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH- , 能使无色酚酞试液变成红色。某科学小组想进一步探究是哪一种粒子使无色酚酞试液变成红色。
[提出猜想]猜想①:可能是H2O;猜想②:可能是Na+;猜想③:可能是OH-。
[实验验证]
实验操作
实验现象
结论
①用试管取少量蒸馏水,滴入1~2滴无色酚酞试液,振荡
试管内溶液仍为无色
H2O不能使无色酚酞试液变红色
②用试管取少量氯化钠溶液,滴入1~2滴无色酚酞试液,振荡
试管内溶液仍为无色
③用试管取少量氢氧化钠溶液,滴入1~2滴无色酚酞试液,振荡
[讨论反思]有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是 。
30. 小金在学习复分解反应时,对复分解反应发生的条件产生了兴趣,于是他和小组内的同学仅用以下药品展开了探究活动。实验药品:稀硫酸、稀盐酸、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、NaCl 溶液、酚酞溶液。小科用,上述物质做了下列几组实验。
组合序号
①
②
③
④
⑤
⑥
组合物质
H2SO4
NaOH
H2SO4
NaCl
H2SO4
Na2CO3
H2SO4
Ba(NO3)2
NaOH
Ba(NO3)2
Na2CO3
Ba(NO3)2
[记录和解释]
组合①、②、⑤均无明显现象,其中组合与另外两组的实质不同。为证明该不同之处,小科在实验过程中使用了酚酞溶液。
[实验结论]
他们请教老师并讨论后知道,只有当两种化合物互相交换成分,生成物中有产生时,复分解反应才可以发生。
[交流与反思]
根据你对物质溶解性的了解,结合复分解反应发生的条件,请写出一种在水溶液中一般不能发生复分解反应的可溶性盐(写化学式)。
31. 某化学兴趣小组同学往NaOH溶液中滴加无色酚酞溶液时,发现溶液变成红色,可是过了一会儿红色消失,重新恢复为无色。于是该小组在老师指导下对这一现象进行了探究。
[提出问题]溶液的红色为什么会变成无色呢?
[猜想与假设]
猜想一:可能是NaOH与空气中的CO2反应了
猜想二:可能是酚酞与空气中的O2反应了
猜想三:可能是与NaOH溶液浓度大小有关
(1)、[讨论交流]小组同学集体讨论后认为猜想一不合理,原因是。(2)、[设计并实验]为了验证猜想二,小组同学进行了如下实验:先向如图装有该NaOH溶液的试管中,从 (选填“a”或者“b”)处通入密度比空气大的稀有气体,将试管内的空气排尽。然后通过注射器滴入无色酚酞溶液,观察到溶液变成红色,过一会儿红色仍然消失。故猜想二错误。(3)、为了验证猜想三,小组同学继续进行实验探究,并得出了实验结论。实验操作
实验现象

1号试管0.1min红色褪去.
2号试管5min红色褪去
3号试管30min红色明显变浅
4号试管120min红色无明显变化
由此得出结论。
(4)、[拓展延伸]小组同学百度“酚酞"得知,酚酞(用H2In表示)其实是一种极弱的酸,遇碱溶液变红的变化可表示为: H2In(无色)城In2-(红色),据此信息写出H2In遇NaOH溶液变红的化学反应方程式为 。32. 用菊花冲泡菊花茶时,某同学发现菊花的花瓣会变成浅绿色。通过查阅资料得知,这是由于花色素发生变化的缘故,并不影响菊花茶的品质。后来该同学又发现用不同的水冲泡菊花茶时,变色的情况又不同。为研究这一问题,他开展了探究活动。冲泡菊花的水
煮沸的井水(弱碱性)
煮沸的纯净水中滴有白醋
煮沸的纯净水
变色情况
变浅绿色
变浅绿色
几乎不变色
(1)、他按一定的步骤进行了探究实验,其结果如上表所示:该同学提出的问题是?(2)、该同学用煮沸的井水冲泡菊花茶时,猜测花瓣变绿快慢还与水温(60℃-90℃)有关,于是他设计实验进行探究。探究过程中还需要表格来记录实验数据,请你帮助他设计表格。33. (某兴趣小组对氢氧化钡溶液和稀盐酸混合后是否发生了化学反应展开了系列实验。[实验操作]用试管取6毫升氢氧化钡溶液,往试管中加入6毫升稀盐酸,等分成两份。
 (1)、[实验证明]往其中一份混合液中滴入几滴酚酞试液,发现溶液呈无色。说明溶液中不存在的离子是 , 证明两者发生了反应。(2)、[继续探究]能否再设计一个实验证明盐酸中H+参加了反应?于是往混合液中滴入石蕊试液,发现变红色,溶液呈酸性,这不能证明盐酸中H+参加了反应。讨论后,形成了新的实验方案,将步骤补充完整:
(1)、[实验证明]往其中一份混合液中滴入几滴酚酞试液,发现溶液呈无色。说明溶液中不存在的离子是 , 证明两者发生了反应。(2)、[继续探究]能否再设计一个实验证明盐酸中H+参加了反应?于是往混合液中滴入石蕊试液,发现变红色,溶液呈酸性,这不能证明盐酸中H+参加了反应。讨论后,形成了新的实验方案,将步骤补充完整:①往盛有另一份混合液的试管中,加入足量的镁片:
②另用试管取3毫升相同质量分数的稀盐酸和3毫升水混合,加入等量的镁片.
证明原混合液的盐酸中H+参加了反应的现象是。
(3)、[微观解释]从微观上分析:氢氧化钡溶液和稀盐酸反应的实质是。四、分析与计算题(共16分)
-
34. 纯碱( Na2CO3)是重要的化工原料,制碱厂生产的纯碱可能会含有少量NaCl。国家规定:优等品中碳酸钠的质量分数不低于99.2%。据此回答下列问题。
 (1)、纯碱在物质分类上属于盐而不是碱,理由是。(2)、现有纯碱样品(杂质仅为少量NaCl),想要测定其是否属于优等品。取样品10克,实验装置如图所示,准确测量排出水的体积,通过计算可得样品的纯度。但实验后发现所测的碳酸钠纯度偏低,造成此结果的原因可能是。 (装置的气密性良好)(3)、请你再设计一种可行的实验方案,实验中的测定值可用字母表示并列化学方程式进行计算碳酸钠的质量。(用分数表示结果)35. 为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气。(样品中其他成分不与稀硫酸反应)
(1)、纯碱在物质分类上属于盐而不是碱,理由是。(2)、现有纯碱样品(杂质仅为少量NaCl),想要测定其是否属于优等品。取样品10克,实验装置如图所示,准确测量排出水的体积,通过计算可得样品的纯度。但实验后发现所测的碳酸钠纯度偏低,造成此结果的原因可能是。 (装置的气密性良好)(3)、请你再设计一种可行的实验方案,实验中的测定值可用字母表示并列化学方程式进行计算碳酸钠的质量。(用分数表示结果)35. 为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气。(样品中其他成分不与稀硫酸反应) (1)、实验前,先往A装置通入一会儿氨气的目的是。(2)、随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(3)、若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由。
(1)、实验前,先往A装置通入一会儿氨气的目的是。(2)、随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(3)、若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由。