高中化学人教版(2019)选择性必修1 第四章第三节 金属的腐蚀与防护
试卷更新日期:2020-10-29 类型:同步测试
一、单选题
-
1. 铜制品上的铝质铆钉,在潮湿的空气中易腐蚀的主要原因可描述为( )A、形成原电池,铝作负极 B、形成原电池,铜作负极 C、形成原电池时,电流由铝流向铜 D、铝质铆钉发生了化学腐蚀2. 下列情形中,相同材质的铁最不易被腐蚀的是( )A、
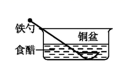 B、
B、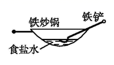 C、
C、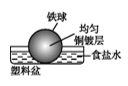 D、
D、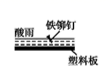 3. 下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )A、地下钢管连接镁块 B、金属护栏表面涂漆 C、汽车底盘喷涂高分子膜 D、水中的钢闸门连接电源的负极4. 碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
3. 下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )A、地下钢管连接镁块 B、金属护栏表面涂漆 C、汽车底盘喷涂高分子膜 D、水中的钢闸门连接电源的负极4. 碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:负极:Fe(s)+ 2HCO3- (aq) -2e- = FeCO3 (s)+H2CO3(aq)(主要)
正极:2H2CO3(aq) +2e- = H2↑+2HCO3- ( aq)(主要)
下列说法错误的是( )
A、钢铁在CO2 水溶液中的腐蚀总反应可表示为CO2+H2O +Fe= FeCO3 +H2 B、深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀 C、碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快 D、腐蚀过程表明含有CO2 的溶液其腐蚀性比相同pH 值的 HCl溶液腐蚀性更强5. 某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述正确的是( )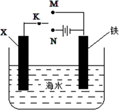 A、若X为碳棒,为减缓铁的腐蚀,开关K应置于M处 B、若X为碳棒,开关K置于N处,会加快铁的腐蚀 C、若X为锌,开关K置于M处,是牺牲阳极的阴极保护法 D、若X为锌,开关K置于N处,铁电极发生的反应为:Fe-2e-=Fe3+6. 下列说法正确的是( )A、Na2O2 在空气中久置,因分解成 Na2O 和 O2 而变成白色固体 B、明矾溶于水能形成胶体,可用于自来水的杀菌消毒 C、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 D、氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却7. 下列有关电化学在生产、生活中的应用分析正确的是( )
A、若X为碳棒,为减缓铁的腐蚀,开关K应置于M处 B、若X为碳棒,开关K置于N处,会加快铁的腐蚀 C、若X为锌,开关K置于M处,是牺牲阳极的阴极保护法 D、若X为锌,开关K置于N处,铁电极发生的反应为:Fe-2e-=Fe3+6. 下列说法正确的是( )A、Na2O2 在空气中久置,因分解成 Na2O 和 O2 而变成白色固体 B、明矾溶于水能形成胶体,可用于自来水的杀菌消毒 C、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 D、氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却7. 下列有关电化学在生产、生活中的应用分析正确的是( ) A、图1:铁钉发生析氢腐蚀 B、图2:可以在铁件上镀铜 C、图3:溶液中c(Cu2+)保持不变 D、图4:将输油管与电源负极相连可以防止腐蚀8. 下列有关原电池和金属腐蚀的说法中,不正确的( )A、铜、锌两电极插入稀H2SO4中组成原电池,铜是正极 B、原电池中e-从负极流出,负极发生氧化反应 C、钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为Fe-3e-=Fe3+ D、电化学腐蚀比化学腐蚀更快更普遍9. 研究性学习小组用如图装置研究钢铁在海水中的腐蚀与防腐,
A、图1:铁钉发生析氢腐蚀 B、图2:可以在铁件上镀铜 C、图3:溶液中c(Cu2+)保持不变 D、图4:将输油管与电源负极相连可以防止腐蚀8. 下列有关原电池和金属腐蚀的说法中,不正确的( )A、铜、锌两电极插入稀H2SO4中组成原电池,铜是正极 B、原电池中e-从负极流出,负极发生氧化反应 C、钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为Fe-3e-=Fe3+ D、电化学腐蚀比化学腐蚀更快更普遍9. 研究性学习小组用如图装置研究钢铁在海水中的腐蚀与防腐,
下列说法正确的是( )
A、1中只发生化学腐蚀 B、2中发生的是析氢腐蚀 C、3为外加电流的阴极保护法 D、钢铁被腐蚀的速率: 1>2>310. 在下列装置中(都盛有0.1mol·L-1H2SO4溶液)Zn片腐蚀最快的是( )A、 B、
B、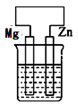 C、
C、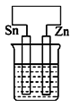 D、
D、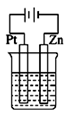
二、综合题
-
11. 如图所示,水槽中试管内有一枚铁钉,放置数天后观察:
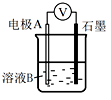
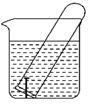 (1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(填“化学”或“电化学”)(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,电极反应式:负极: , 正极:。(3)、若试管内液面下降,则原溶液呈性,发生腐蚀,电极反应式:负极: , 正极:。12.(1)、电化腐蚀是钢铁发生腐蚀的主要原因,当水膜氢离子浓度较小时,主要发生腐蚀,其负极反应式为 , 正极反应式为。(2)、将氯化铁溶液蒸干灼烧得到的固体物质是;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。(3)、除CaSO4水垢的方法,写出反应的化学方程式、;热的纯碱溶液洗涤效果更好的原理是;明矾净水的离子方程式。(4)、在2 mL 0.1 mol·L-1的NaCl溶液中,加入2 mL 0.1 mol·L-1的AgNO3溶液,可观察到 , 此反应的离子方程式为。 将此混合液过滤,滤渣加入2 mL 0.1 mol·L-1的KI溶液,搅拌,可观察到 , 反应的离子方程式为。(5)、对于Ag2S(s) 2Ag+(aq)+S2-(aq),其Ksp的表达式为。13. 某小组同学利用原电池装置探究物质的性质。
(1)、铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。(填“化学”或“电化学”)(2)、若试管内液面上升,则原溶液呈性,发生腐蚀,电极反应式:负极: , 正极:。(3)、若试管内液面下降,则原溶液呈性,发生腐蚀,电极反应式:负极: , 正极:。12.(1)、电化腐蚀是钢铁发生腐蚀的主要原因,当水膜氢离子浓度较小时,主要发生腐蚀,其负极反应式为 , 正极反应式为。(2)、将氯化铁溶液蒸干灼烧得到的固体物质是;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。(3)、除CaSO4水垢的方法,写出反应的化学方程式、;热的纯碱溶液洗涤效果更好的原理是;明矾净水的离子方程式。(4)、在2 mL 0.1 mol·L-1的NaCl溶液中,加入2 mL 0.1 mol·L-1的AgNO3溶液,可观察到 , 此反应的离子方程式为。 将此混合液过滤,滤渣加入2 mL 0.1 mol·L-1的KI溶液,搅拌,可观察到 , 反应的离子方程式为。(5)、对于Ag2S(s) 2Ag+(aq)+S2-(aq),其Ksp的表达式为。13. 某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)、同学们利用下表中装置进行实验并记录。装置
编号
电极A
溶液B
操作及现象
Ⅰ
Fe
pH=2的H2SO4
连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ
Cu
pH=2的H2SO4
连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
① 同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
② 针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
(2)、同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。编号
溶液B
操作及现象
Ⅲ
经煮沸的pH=2的 H2SO4
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ
pH=2的H2SO4
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ
pH=12的NaOH
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
① 丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。
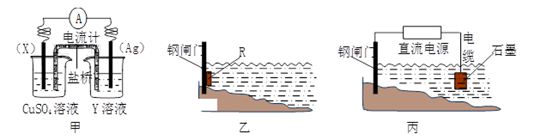
14.(1)、依据反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。①电极X的材料是;Y溶液可以是;
②银电极上发生的电极反应式是。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是(填离子符号)。
(2)、金属腐蚀一般可分为化学腐蚀和电化学腐蚀,可以采用电化学手段进行防腐。①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的极。
 (3)、蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
(3)、蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。①若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的pH(填增大、减小、不变)
③充电时该电池阳极的电极反应式。