高中化学人教版(2019)选择性必修1 第四章第二节 电解池
试卷更新日期:2020-10-29 类型:同步测试
一、单选题
-
1. 下列与电化学相关的叙述中正确的是( )A、原电池中正极发生氧化反应 B、电解池中与电源负极相连的是阳极 C、电镀液中应含有镀层金属阳离子 D、电解氯化钠溶液可制备金属钠2. 下列实验装置符合实验目的的是( )
目的
粗铜的精炼
验证NaCl溶液(含酚酞)的产物
装置
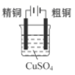
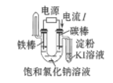
选项
A
B
目的
在铁制品上镀铜
构成原电池
装置
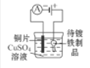
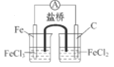
选项
C
D
A、A B、B C、C D、D3. 将下图所示实验装置的K闭合,下列判断正确的是( )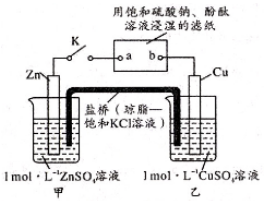 A、Cu电极上发生还原反应 B、电子沿Zn→a→b→Cu路径流动 C、片刻后甲池中 增大 D、片刻后可观察到滤纸b点变红色4. 如图所示,用石墨电极电解饱和食盐水。下列说法错误的是( )
A、Cu电极上发生还原反应 B、电子沿Zn→a→b→Cu路径流动 C、片刻后甲池中 增大 D、片刻后可观察到滤纸b点变红色4. 如图所示,用石墨电极电解饱和食盐水。下列说法错误的是( )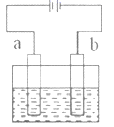 A、通电使NaCl 发生电离 B、电极a 是阳极 C、Na+向 b 极移动 D、a 极产生黄绿色气体5. 探究电场作用下阴阳离子的迁移。a、b、c、d均为石墨电极,电极间距4cm。将pH试纸用不同浓度 溶液充分润湿,进行如下实验:
A、通电使NaCl 发生电离 B、电极a 是阳极 C、Na+向 b 极移动 D、a 极产生黄绿色气体5. 探究电场作用下阴阳离子的迁移。a、b、c、d均为石墨电极,电极间距4cm。将pH试纸用不同浓度 溶液充分润湿,进行如下实验: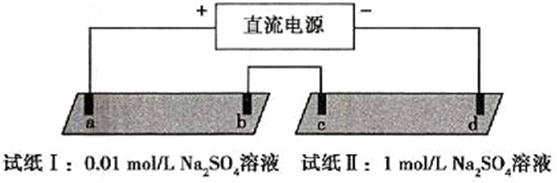
实验现象:
时间
试纸I
试纸II
1min
a极附近试纸变红,b极附近试纸变蓝
c极附近试纸变红,d极附近……
10min
红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm
两极颜色范围扩大不明显,试纸大部分仍为黄色
下列说法不正确的是( )
A、d极附近试纸变蓝 B、a极附近试纸变红的原因是: 2H2O+2e-=H2↑+2OH- C、对比试纸I和试纸Ⅱ的现象,说明电解质浓度影响H+和OH-的迁移 D、试纸I的现象说明,此环境中 的迁移速率比OH-快6. 用石墨作电极电解下列四种溶液,以下说法错误的是( )A、电解AgNO3溶液,阳极生成O2 , 溶液的酸性增强 B、电解浓ZnBr2溶液,阴极反应式为Zn2++2e-=Zn C、电解AlCl3溶液,总反应的离子方程式:2H2O+2Cl- 2OH-+Cl2↑+H2↑ D、电解Pb(NO3)2和CuCl2的混合溶液,可明显分为三个阶段7. 镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )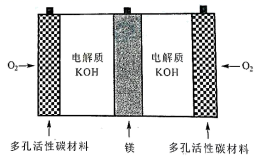 A、放电时,外电路电子由多孔碳材料电极流向镁电极 B、放电时,正极的电极反应式为O2+4e-+2H2O=4OH- C、理论上,外电路中流过2mol电子时,负极质量增加34g D、电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用8. 某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A、放电时,外电路电子由多孔碳材料电极流向镁电极 B、放电时,正极的电极反应式为O2+4e-+2H2O=4OH- C、理论上,外电路中流过2mol电子时,负极质量增加34g D、电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用8. 某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )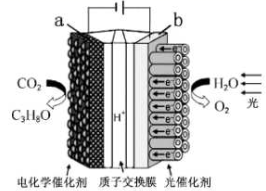 A、该装置将化学能转化为光能和电能 B、该装置工作时,H+从b极区向a极区迁移 C、每生成1 mol O2 , 有44 gCO2被还原 D、a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O9. 根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )A、
A、该装置将化学能转化为光能和电能 B、该装置工作时,H+从b极区向a极区迁移 C、每生成1 mol O2 , 有44 gCO2被还原 D、a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O9. 根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )A、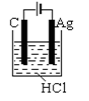 B、
B、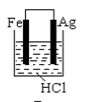 C、
C、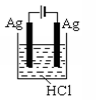 D、
D、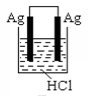 10. 如图a、b、c、d均为铂电极,供选择的电解质溶液如下表( )
10. 如图a、b、c、d均为铂电极,供选择的电解质溶液如下表( )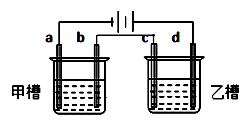
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组
A
B
C
D
甲槽
NaOH
Cu(NO3)2
KCl
Na2SO4
乙槽
CuSO4
NaCl
AgNO3
NaNO3
A、A B、B C、C D、D二、综合题
-
11. 如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
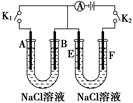 (1)、打开K2 , 合并K1。A的电极反应为。最终可观察到的现象是。(2)、打开K1 , 合并K2。F极的电极反应为 , 检验F极产生气体的方法是。(3)、若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 , 原因是。12.(1)、(Ι)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气.则此电池的正极发生的电极反应式是 。(2)、(Ⅱ)某课外活动小组用如图装置进行实验,试回答下列问题:
(1)、打开K2 , 合并K1。A的电极反应为。最终可观察到的现象是。(2)、打开K1 , 合并K2。F极的电极反应为 , 检验F极产生气体的方法是。(3)、若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 , 原因是。12.(1)、(Ι)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气.则此电池的正极发生的电极反应式是 。(2)、(Ⅱ)某课外活动小组用如图装置进行实验,试回答下列问题: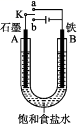
若开始时开关K与a连接,则B极的电极反应为。
(3)、若开始时开关K与b连接,则总反应的离子方程式为。(4)、(Ⅲ)如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近溶液呈红色。请回答: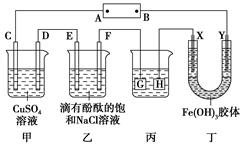
A极是电源的 , 一段时间后,甲中溶液的pH(填“增大”“减小”或“不变”),丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明在电场作用下向Y极移动。
(5)、若甲、乙装置中的C、D、E、F电极上均只有一种单质生成时,C极和F极对应单质的物质的量之比为。(6)、现用丙装置给铜件镀银,则电镀液是溶液。13. 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。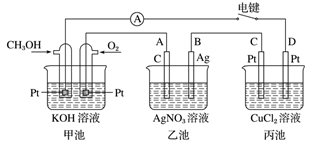
请回答下列问题:
(1)、甲池为(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为。(2)、乙池中A(石墨)电极的名称为(填“正极”“负极”“阴极”或“阳极”),总反应式为。(3)、当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为mL(标准状况下),丙池中极(填C或D)析出g铜。(4)、若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将(填“增大”“减小”或“不变”);丙中溶液的pH将(填“增大”“减小”或“不变”)。(5)、一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为;正极反应式为。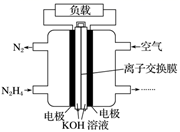 14. 如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
14. 如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答: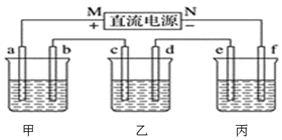 (1)、b极上的电极反应式为 , 检验a电极上产生的气体的方法是 , 甲电池的总反应化学方程式是。(2)、在粗铜的电解过程中,图中c电极的材料是 (填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是 , 电解一段时间后,电解液中的金属离子有。(3)、如果要在铁制品上镀镍(二价金属),则e电极的材料是 (填“铁制品”或“镍块”,下同),f电极的材料是。(4)、若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为。15.(1)、海水资源的利用具有广阔前景。海水中主要离子的含量如下:
(1)、b极上的电极反应式为 , 检验a电极上产生的气体的方法是 , 甲电池的总反应化学方程式是。(2)、在粗铜的电解过程中,图中c电极的材料是 (填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是 , 电解一段时间后,电解液中的金属离子有。(3)、如果要在铁制品上镀镍(二价金属),则e电极的材料是 (填“铁制品”或“镍块”,下同),f电极的材料是。(4)、若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为。15.(1)、海水资源的利用具有广阔前景。海水中主要离子的含量如下:成分
含量/(mg/L)
成分
含量/(mg/L)
Cl-
18980
Ca2+
400
Na+
10560
142
2560
Br-
64
Mg2+
1272
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。

①电解氯化钠溶液的离子方程式。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因。 在阴极附近产生少量白色沉淀,其成分有和CaCO3。
③淡水的出口为(填“a”、“b”或“c”);a 出口物质为(填化学式)。
④若用下面燃料电池为电源电解 100mL1mol•L-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为(忽略反应前后溶液体积变化)
(2)、如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,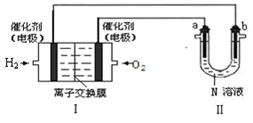
①Ⅰ中通入O2的一端为电池的极。 通入H2的一端的电极反应式
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是 , N 溶液为溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是 , N 溶液为 溶液。
(3)、工业上用 Na2SO3 溶液吸收 SO2 , 过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n( ):n( ) 变化关系如下表:n( ): n( )
91:9
1:1
9:91
pH
8.2
7.2
6.2
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:
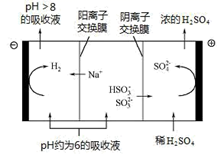
① 在阳极放电的电极反应式是。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:。