高中化学人教版(2019)选择性必修1 第四章第一节 原电池
试卷更新日期:2020-10-29 类型:同步测试
一、单选题
-
1. 下列能量的转化过程中,由化学能转化为电能的是( )
A
B
C
D




水力发电
风力发电
铅蓄电池放电
太阳能发电
A、A B、B C、C D、D2. 下列各组材料中,不能组成原电池的是( ) A、A B、B C、C D、D3. 微生物脱盐电池是高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( )
A、A B、B C、C D、D3. 微生物脱盐电池是高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( ) A、隔膜1为阳离子交换膜,隔膜2为阴离子交换膜 B、负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+ C、当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g D、电池工作一段时间后,正、负极产生气体的物质的量之比为2:14. 化学兴趣小组设计了一个简易原电池装置如图所示,反应原理为 Cu+2AgNO3 = 2Ag+ Cu(NO3)2。下列叙述正确的是( )
A、隔膜1为阳离子交换膜,隔膜2为阴离子交换膜 B、负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+ C、当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g D、电池工作一段时间后,正、负极产生气体的物质的量之比为2:14. 化学兴趣小组设计了一个简易原电池装置如图所示,反应原理为 Cu+2AgNO3 = 2Ag+ Cu(NO3)2。下列叙述正确的是( ) A、银离子向铜极移动 B、铜极为该装置的正极 C、溶液的质量逐渐变小 D、石墨极上发生氧化反应5. 欧洲足球锦标赛事中的拍摄车,装着“绿色心脏”一质子交换膜燃料电池,其工作原理如图所示。下列叙述中正确的是( )
A、银离子向铜极移动 B、铜极为该装置的正极 C、溶液的质量逐渐变小 D、石墨极上发生氧化反应5. 欧洲足球锦标赛事中的拍摄车,装着“绿色心脏”一质子交换膜燃料电池,其工作原理如图所示。下列叙述中正确的是( ) A、装置中的能量变化为电能转化为化学能 B、通入氢气的电极发生氧化反应 C、通入空气的电极反应式:O2+4e-+2H2O=4OH- D、装置中电子从通入空气的电极经过导线流向通入氢气的电极6. 如图为某种甲醇燃料电池示意图。下列判断正确的是( )
A、装置中的能量变化为电能转化为化学能 B、通入氢气的电极发生氧化反应 C、通入空气的电极反应式:O2+4e-+2H2O=4OH- D、装置中电子从通入空气的电极经过导线流向通入氢气的电极6. 如图为某种甲醇燃料电池示意图。下列判断正确的是( ) A、电极A反应式:CH3OH-6e-+H2O=CO2+6H- B、B电极为负极 C、B电极附近溶液pH增大 D、电池工作时,溶液中电子由电极B流向电极A7. 将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2 , 即可产生电流,此装置称为甲烷燃料电池。下列叙述中正确的是( )
A、电极A反应式:CH3OH-6e-+H2O=CO2+6H- B、B电极为负极 C、B电极附近溶液pH增大 D、电池工作时,溶液中电子由电极B流向电极A7. 将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2 , 即可产生电流,此装置称为甲烷燃料电池。下列叙述中正确的是( )①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4eˉ=4OHˉ;
③放电时溶液中的阳离子向正极移动;
④负极的电极反应式为:CH4+10OHˉ-8eˉ= +7H2O;
⑤电子迁移方向:通入CH4的铂电极→通入O2的铂电极→电解质溶液→通入CH4的铂电极
A、①③⑤ B、②③④ C、②④⑤ D、①②③8. 可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是( )A、电池工作时,电子通过外电路从正极流向负极 B、以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓ C、以NaOH溶液为电解液时,电池在工作过程中电解质溶液的碱性保持不变 D、以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-二、综合题
-
9. A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
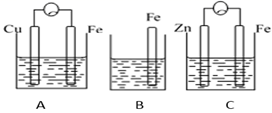 (1)、B中反应的离子方程式为。(2)、A中作正极的金属是 , 该电极上看到的现象为。(3)、C中作负极的金属是 , 该电极反应方程式为。(4)、现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发生反应。(填“氧化”或“还原”)。10. 下图为两种铜锌原电池的示意图。
(1)、B中反应的离子方程式为。(2)、A中作正极的金属是 , 该电极上看到的现象为。(3)、C中作负极的金属是 , 该电极反应方程式为。(4)、现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发生反应。(填“氧化”或“还原”)。10. 下图为两种铜锌原电池的示意图。 (1)、写出它们工作时正极的电极反应式。(2)、①电池B工作时盐桥中的K+流动方向(填“向ZnSO4”或“向CuSO4”)溶液;
(1)、写出它们工作时正极的电极反应式。(2)、①电池B工作时盐桥中的K+流动方向(填“向ZnSO4”或“向CuSO4”)溶液;②假如Zn的消耗速率为2×10-3 mol·s-1 , 计算K+的迁移速率。
(3)、电池A与电池B比较,电池B的工作效率大大提高,说明原因。(4)、利用电池A进行实验,发现铜片、锌片表面均有红色物质析出。实验结束时测得锌片减少了1.97 g,铜片增重了1.92 g,计算该原电池的工作效率[指参加原电池反应的锌占锌反应总量的百分率]。11. H2S有剧毒,在空气中可以燃烧。以硫化氢、氧气为原料,可以设计一种燃料电池。回答下列问题:
(1)、H2S在空气中充分燃烧,能量变化过程如图所示:
①反应过程中反应物的总能量 (填“>”“<”或“=”)生成物的总能量。
②H2S完全燃烧的化学方程式为 。
(2)、以 H2S、O2 为原料的碱性燃料电池装置的示意图如图,该装置工作时总反应离子方程式为2H2S+3O2+4OH- = 2SO32- +4H2O。
①该装置将 能转化为 能。
②已知正极反应式 O2+2H2O+4e- =4OH- ,则负极反应式为 ,右室电解质溶液的pH (填“变大”“减小”或“不变”)。
12.(1)、理论上任何一个自发的氧化还原反应均可以设计成原电池。根据氧化还原反应Fe+2Fe3+=3Fe2+设计的原电池如图所示,其中盐桥内装琼脂饱和KNO3溶液。
请回答下列问题:
①电解质溶液X是;电解质溶液Y是。
②写出两电极的电极反应式:铁电极:;碳电极:。
③外电路中的电子是从电极流向电极。(填“铁”或“碳”)
④盐桥中向X溶液中迁移的离子是(填字母):A.K+ B.NO3-
(2)、请将下列氧化还原反应3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O设计成原电池,画出(1)中的装置图,并写出相应的电极反应式。①原电池装置图:;
②正极:;
③负极:。
13. 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)、由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、(从下列图中选择,写出名称)。 (2)、电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。
(2)、电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。阳离子
u∞×108/(m2·s−1·V−1)
阴离子
u∞×108/(m2·s−1·V−1)
Li+
4.07
4.61
Na+
5.19
7.40
Ca2+
6.59
Cl−
7.91
K+
7.62
8.27
(3)、电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入电极溶液中。(4)、电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=。(5)、根据(3)、(4)实验结果,可知石墨电极的电极反应式为 , 铁电极的电极反应式为。因此,验证了Fe2+氧化性小于 , 还原性小于。(6)、实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是。