高中化学人教版(2019)选择性必修1 第三章测试卷
试卷更新日期:2020-10-29 类型:单元试卷
一、单选题
-
1. 常温下,在醋酸溶液中加入一定量的醋酸钠固体,下列说法错误的是( )A、c(OH-)减小 B、醋酸的电离程度减小 C、溶液的pH增大 D、c(Ac-)增大2. 水溶液呈酸性的是( )A、 B、 C、 D、3. 有关酸碱滴定实验,下列说法的正确的是( )A、滴定管和锥形瓶都需要使用蒸馏水和待装液润洗 B、滴定前,必须将滴定管中液体的液面调至0刻度 C、滴定至终点时,溶液一定呈中性 D、测定待测液的浓度,至少需要完成两组平行实验,取消耗标准液的平均值4. 298K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO−的浓度存在关系式c(HCOO−)+c(HCOOH)=0.100mol·L−1 , 而含碳元素的粒子的浓度与pH的关系如图所示:

下列说法正确的是( )
A、0.1mol·L−1HCOONa溶液中有c(HCOO−)+c(HCOOH)+c(OH−)=c(H+)+0.1 B、298K时,HCOOH的电离常数Ka=1.0×10−3.75 C、298K时,加蒸馏水稀释P点溶液,溶液中n(H+)·n(OH−)保持不变 D、0.1mol·L−1HCOONa溶液和0.1mol·L−1HCOOH溶液等体积混合后混合液的pH=3.75(混合后溶液体积变化忽略不计)5. 下列说法一定正确的是( )A、某蒸馏水水样 pH=6,则该水样中一定掺杂或溶解了某些溶质 B、相同温度下,中和等 pH 的氨水、NaOH 溶液,所需 HCl 的物质的量前者更多 C、相同温度下,pH 相等的 NaHSO4、H3PO4 溶液中,水电离的 H+浓度相等 D、氨水和硫酸反应后的溶液,若溶液呈中性,则 c(SO42-)=c(NH4+)×26. 室温下,用相同浓度的NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的三种酸(HA、HB和HC)溶液,滴定的曲线如图所示,下列判断错误的是( ) A、当中和百分数达50%时: B、滴定至①点时,溶液中: C、当中和百分数达100%时,消耗的NaOH溶液体积 D、①和④所示溶液中都有:7. 对下列实验现象或操作解释正确的是( )
A、当中和百分数达50%时: B、滴定至①点时,溶液中: C、当中和百分数达100%时,消耗的NaOH溶液体积 D、①和④所示溶液中都有:7. 对下列实验现象或操作解释正确的是( )现象或操作
解释
A
KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去
SO2具有漂白性
B
配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉
抑制Fe3+水解,并防止Fe3+变质
C
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
不能说明该溶液中一定含有SO42-
D
向含有Cu(OH)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀
Ksp(Ag2S)<Ksp(CuS)
A、A B、B C、C D、D8. 常温下,在下列溶液中可能大量共存的离子组是( )A、pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- B、由水电离出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl- C、c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3- D、滴加KSCN变红色的溶液:Na+、K+、Al3+、CO32-9. 25 ℃时,水的电离达到平衡:H2O H++OH- , 下列叙述正确的是( )A、向水中加入NaHSO4固体,平衡逆向移动,c(H+)降低 B、将水加热,Kw增大,pH不变 C、向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低 D、向水中加入固体氢氧化钠,平衡逆向移动,c(OH-)增大10. 下列有关说法中不正确的是( )A、某温度时的混合溶液中c(H+) = mol·L-1 , 说明该溶液呈中性(KW为该温度时水的离子积常数) B、常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 C、常温下,pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-) D、常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)11. 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中 变化的曲线如图所示。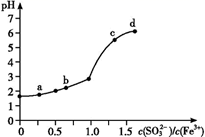
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是( )
A、检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液 B、c点和d点出现上述现象的主要原因是Fe3+和 发生双水解反应 C、b点较a点溶液pH升高的主要原因:2Fe3++ +H2O = 2Fe2++ +2H+ D、向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+12. 向MnCl2溶液中加入过量难溶电解质MnS,可使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子转化为硫化物沉淀,从而得到纯净的MnCl2。下列分析正确的是( )A、MnS溶解度大于CuS、PbS、CdSb B、MnS有还原性,可将Cu2+、Pb2+、Cd2+还原后除去 C、MnS具有吸附性 D、MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓二、综合题
-
13. 有以下物质:①FeCl3;②稀NaOH溶液;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦稀盐酸;⑧纯醋酸;⑨Na2CO3;(1)、其中能导电的是;属于非电解质的是;属于强电解质的是;属于弱电解质的是。(2)、写出物质⑥溶于水的电离方程式:。(3)、写出物质⑥和⑧在水中反应的离子方程式。(4)、有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是(5)、现取0.1mol样品⑨,逐滴加入⑦,现象为 , 其所发生的离子方程式为。完全反应时生成气体的物质的量为。14. 计算下列各题在常温下的数值(lg2=0.3、lg3=0.477、lg5=0.7)。(1)、0.005mol/L的氢氧化钡溶液的pH=。(2)、0.1mol/L的醋酸的pH=(电离度=1%)。(3)、pH=12的NaOH溶液加水稀释到原来的10倍,则溶液的pH=。(4)、pH=12氨水加水稀释到原来100倍,溶液的pH值范围。(5)、pH=1和pH=3的硫酸等体积混合后溶液的pH= , c(H+)水=。(6)、pH=13 的强碱与 pH=2 的强酸溶液混合,所得混合液的 pH=11,则强碱与强酸的体积比为。15.(1)、常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1 L溶液
①该溶液中除H2O的电离平衡外还存在的平衡体系是。
②溶液中共有种不同的微粒。
③这些粒子中浓度为0.01mol·L-1的是 , 浓度为0.002mol·L-1的是。
④物质的量之和为0.01mol的两种微粒是。
(2)、某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB- H++B2- ,回答下列问题:
①已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中c(H+)(填“<”、“>”、“=”)0.11 mol·L-1理由是。
②0.1 mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是。
16. 环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
已知:①酸浸后的溶液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子
Fe3+
Mg2+
Al3+
Cr3+
沉淀完全时的pH
3.7
11.1
5.4
9
沉淀溶解时的pH
—
—
>8溶解
>9溶解
(1)、如需配制480 mL酸浸环节所需的硫酸,需要用量筒量取18.4 mol·L-1的浓硫酸mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器。(2)、经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O72- , 写出此反应的离子方程式:。(3)、调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因。(4)、钠离子交换树脂的反应原理为Mn++nNaR⇌MRn+nNa+ , 则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有。(5)、请写出流程中用SO2进行还原时发生反应的离子方程式:。(6)、沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:银盐性质
AgCl
AgI
AgCN
Ag2CrO4
AgSCN
颜色
白
黄
白
砖红
白
Ksp
1.8×10-10
8.3×10-17
1.2×10-16
3.5×10-11
1.0×10-12
①滴定时可选为滴定指示剂的是(填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
②如何确定该滴定过程的终点:。
17. 难溶电解质在水中存在沉淀溶解平衡,如AgCl Ag++Cl- 上述平衡中存在两个过程:一方面是在水分子的作用下,溶液中少量的Ag+和Cl—脱离AgCl表面进入水中(溶解过程);另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl表面析出(沉淀过程)。当溶解速率和沉淀速率相等时,形成AgCl饱和溶液,达到沉淀溶解平衡。用溶度积常数表示: Ksp=c(Ag+)•c(Cl-)。当溶液中的c(Ag+)•c(Cl-)> Ksp(AgCl)时,即有沉淀析出。已知:在室温下,Ksp(AgBr)=5.4×10 -13 , Ksp(AgCl)=1.8×10 -10
向 BaCl2溶液中加入 AgNO3和 KBr,当两种沉淀刚好共存时,溶液中 = 。
写出简要计算过程:
18. 镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。(1)、某蓄电池反应为2NiO(OH)+Cd+2H2O Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是(填化学式),放电时若生成73gCd(OH)2 , 则外电路中转移的电子数是。(2)、镍的羰化反应为:Ni(s)+4CO(g) Ni(CO)4(g) ΔH。①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,5s后测得Ni(CO)4的物质的量为1.5mol,则0~5s内平均反应速率v(CO)=mol·L·s-1。
②该反应的平衡常数K随温度升高而减小,则该反应的ΔH0(填“>”或“<")。
(3)、NiSO4·6H2O晶体是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料制取。制取步骤如下: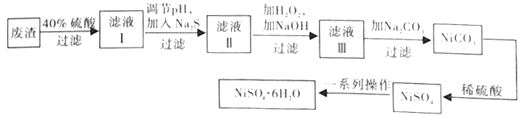
①在实验室中,欲用98%的浓硫酸(密度1.84g·mL-1)配制40%的稀硫酸,需要的玻璃仪器除玻璃棒外,还有。
②向滤液Ⅰ中加入Na2S的目的是。(已知:Ksp[FeS]=6.3×10-18 , Ksp[CuS]=1.3×10-36 , Ksp[ZnS]=1.3×10-24 , Ksp[NiS]=1.1×10-21)
③滤液Ⅲ中所含的阳离子主要有。
④NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为。
⑤在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是(写出一条即可)。