高中化学人教版(2019)选择性必修1 第三章第二节 水的电离和溶液的pH
试卷更新日期:2020-10-29 类型:同步测试
一、单选题
-
1. 有关酸碱中和滴定的说法正确的是( )A、可用石蕊作指示剂 B、滴定时眼睛注视滴定管中液面下降 C、需做平行实验2~3次 D、当溶液颜色变化时立即读数2. 25℃时,下列溶液中水的电离程度最小的是( )A、pH=11 的氨水 B、0.01 mol/L的 Na2CO3溶液 C、pH=2的NaHSO4溶液 D、0.1 mol/L的盐酸3. 常温下,在体积均为20mL、浓度均为0.1mol•L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)的负对数[-lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示:下列说法错误的是( )
 A、a、b、c三点溶液均显中性 B、a点溶液,c(Na+)=c(X-)>c(H+)=c(OH-) C、b点溶液中的离子总浓度大于d点溶液 D、常温下,Ka(HX)≈10-54. 25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。
A、a、b、c三点溶液均显中性 B、a点溶液,c(Na+)=c(X-)>c(H+)=c(OH-) C、b点溶液中的离子总浓度大于d点溶液 D、常温下,Ka(HX)≈10-54. 25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。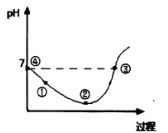
下列叙述中正确的是( )
A、滴定过程中,当水电离的c(H+)=10-7mol/L时,溶液显中性 B、滴定过程中宜选用酚酞为指示剂,不宜选用甲基橙为指示剂 C、②点的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-) D、③点溶液中c(K+)+c(H+)=c(OH-)+c(Cl-)5. 常温下,0.05 mol/L稀硫酸中OH-浓度是(mol/L)( )A、1×10-12 B、2×10-12 C、1×10-13 D、2×10-136. 25℃时,重水(D2O)的离子积为 1.6×10ˉ15 , 也可用与 pH 一样的定义来规定其酸碱度:pD=-lgc(D+),下列叙述正确的是(均为 25℃条件下)( )A、重水和水两种液体,D2O 的电离度大于 H2O B、在 100mL0.25mol·Lˉ1DCl 重水溶液中,加入 50mL0.2mol·Lˉ1NaOD 重水溶液,反应后溶液的 pD=1 C、0.01 mol·Lˉ1NaOD 重水溶液,其 pD=12 D、NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·D2O 和 HD2O+7. 在指定条件下,下列各组离子一定能大量共存的是( )A、滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- B、滴入KSCN显血红色的溶液中:NH4+、Al3+、NO3-、SO42- C、c(OH-)/c(H+)=1012的溶液中:NH4+、K+、Cl-、HCO3- D、由水电离的c(H+)=1.0×10-13 mol·L-1溶液中:K+、Al3+、SO42-、CH3COO-8. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、 c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN- B、使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO4- C、由水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、K+、CO32-、SO42- D、 =10-12的溶液中:Mg2+、Al3+、NO3-、SO42-9. 25℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0 ,下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,pH不变10. 将①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO3- ⑧NH4+分别加入H2O中,基本不影响水的电离平衡的是( )A、①③⑤⑦⑧ B、①⑥ C、②④⑦ D、②④⑥⑧11. 313 K时,水的离子积Kw=2.9×10-14 , 则在313 K时,c(H+)=10-7mol/L的溶液( )A、呈酸性 B、呈中性 C、呈碱性 D、无法判断12. 下列有关化学平衡常数K、电离平衡常数Ka、水的离子积常数Kw的说法中错误的是( )A、各常数的大小与温度有关 B、各常数的大小说明平衡体系正反应的程度大小 C、若温度升高则各常数一定增大 D、化学平衡常数越大反应物平衡转化率越大二、实验探究题
-
13. 某小组同学设计实验,探究中和反应的发生。
(实验过程)
编号
实验操作
实验I
向滴有酚酞的氢氧化钠溶液中滴加稀盐酸,观察现象

实验II
按如图进行实验,对比①、②中的实验现象
 (1)、(分析与解释)
(1)、(分析与解释)中和反应的实质是(用离子方程式表示)。
(2)、实验I中,中和反应发生的现象是。(3)、实验II中,能判断中和反应发生的依据是。a.反应结束消耗镁条的量②>①
b.镁条表面产生气泡的速率①>②
(4)、实验II中,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是。14. 某学习小组为了探究CH3COOH的电离情况,进行了如下实验。(1)、(实验一)测定醋酸溶液中CH3COOH的物质的量浓度。用 0.2000mol/L 的 NaOH 溶液滴定 20.00mL 醋酸溶液,3 次滴定所消耗NaOH溶液的体积如下:
实验次数
1
2
3
消耗NaOH 溶液的体积/mL
20.05
20.00
19.95
量取 20.00 mL 醋酸溶液所用的仪器是(填字母)


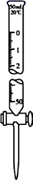

a
b
c
d
(2)、以上醋酸溶液中CH3COOH的物质的量浓度为(3)、(实验二)探究浓度对CH3COOH电离程度的影响。用 pH 计测定 25℃时不同浓度的醋酸的 pH,结果如下:
浓度/(mol·L-1)
0.2000
0.1000
0.0100
pH
2.83
2.88
3.38
根据表中数据可知CH3COOH是电解质(填“强”或“弱”) 得出此结论的依据是
(4)、写出CH3COOH的电离方程式三、综合题
-
15.(1)、某温度下纯水中c(H+)=2×10-7 mol/L,若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6 mol/L,此时溶液中的c(OH-)=8×10-9 mol/L,滴入盐酸后水的离子积 不变(填“变大”“变小”或“不变”,下同),水的电离度变小(2)、今有A.CH3COOH B.HCl C.H2SO4三种溶液,
①当它们pH相同时,其物质的量浓度由大到小是A>B>C(用字母表示,下同);
②体积和物质的量浓度相同的三种溶液,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积由大到小为
(3)、体积相同pH均等于12的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为16. 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:实验编号
起始浓度/(mol·L-1)
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
(1)、实验①反应后的溶液pH=9的原因是(用离子方程式表示)。(2)、实验①和实验②中水的电离程度较大的是 , 该溶液中由水电离出的c(OH-)=。(3)、x0.2 (填“>”“<”或“=”),若x=a , 则室温下HA的电离平衡常数Ka=(用含a的表达式表示)。(4)、若用已知浓度的KOH滴定未知浓度的一元酸HA,滴定终点的判断方法是。17.(1)、① NH3 ②SO3 ③ Cl2 ④ BaSO4 ⑤酒精⑥ CH3COONH4 ⑦HClO⑧Cu,以上物质中 属于非电解质的是 , 属于强电解质的是(填入编号)(2)、已知醋酸和盐酸是极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ 。①下列方法中,可以使 0.1mol/CH3COOH的电离程度增大的是。
a. 加入少量 0.1mol/L的稀盐酸 b. 加入少量 0.1mol/LCH3COOHc. 加水稀释至 0.01mol/L d. 加入少量冰醋酸e. 加入少量醋酸钠固体 f. 加入少量 0.1mol/L的NaOH溶液
②常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1 , 醋酸溶液中加入的Zn粒质量为m2 , 则m1m2(填“<”、“=”、“>”)。
