高中化学人教版(2019)必修第一册 第四章第二节 元素周期律
试卷更新日期:2020-10-29 类型:同步测试
一、单选题
-
1. W、X、Y、Z 是原子序数依次增大的短周期主族元素,W的氢化物水溶液能蚀刻玻璃,X、Y处于相邻位置,Y的最高正价与最低负价代数和为零,W、X 原子的最外层电子数之和与Y、Z 原子的最外层电子数之和相等。下列说法错误的是( )A、原子半径 : X > Y > Z > W B、最高正价:W > Z > Y > X C、简单氢化物的热稳定性:W > Z > Y D、简单离子的电子层结构: W与X相同2. 下列结论正确的是( )
①离子半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si ⑦金属性:Be<Mg<Ca<K
A、只有②⑤⑦ B、只有②⑥⑦ C、只有②④⑤⑥⑦ D、只有②④⑥3. 一种广泛用于锂离子电池的物质,其结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是( ) A、非金属性 B、X分别与Y和W形成的三原子化合物均可作为灭火剂 C、X的氢化物可与Z的单质发生反应 D、Y在该化合物中有两种不同价态4. 瑞德西韦是抗击新型肺炎的明星潜力药,其由 H、C、N、O、P五种元素组成。下列叙述错误的是( )A、简单离子半径:P3- >N3- >O2- B、由 H、N、O 组成的化合物都是共价化合物 C、最简单氢化物的热稳定性:H2O>NH3 D、最高价氧化物对应水化物的酸性:HNO3>H3PO45. 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是( )
A、非金属性 B、X分别与Y和W形成的三原子化合物均可作为灭火剂 C、X的氢化物可与Z的单质发生反应 D、Y在该化合物中有两种不同价态4. 瑞德西韦是抗击新型肺炎的明星潜力药,其由 H、C、N、O、P五种元素组成。下列叙述错误的是( )A、简单离子半径:P3- >N3- >O2- B、由 H、N、O 组成的化合物都是共价化合物 C、最简单氢化物的热稳定性:H2O>NH3 D、最高价氧化物对应水化物的酸性:HNO3>H3PO45. 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是( ) A、元素X与元素Z的最高正化合价之和的数值等于8 B、原子半径的大小顺序为:rX>rY>:rZ>rW>rQ C、离子Y2-和Z 3+的核外电子数和电子层数都不相同 D、元素W的最高价氧化物对应的水化物的酸性比Q的强6. 如图为元素周期表中短周期的一部分,Y最外层电子比最内层电子多4个,则下列说法正确的是( )
A、元素X与元素Z的最高正化合价之和的数值等于8 B、原子半径的大小顺序为:rX>rY>:rZ>rW>rQ C、离子Y2-和Z 3+的核外电子数和电子层数都不相同 D、元素W的最高价氧化物对应的水化物的酸性比Q的强6. 如图为元素周期表中短周期的一部分,Y最外层电子比最内层电子多4个,则下列说法正确的是( )R
X
Y
Z
A、化合物XZ5中的所有原子最外层都达到了8电子稳定结构 B、元素Z的氧化物对应的水化物一定是强酸 C、R的氢化物比Y的氢化物沸点高 D、R的最高价是+67. 短周期元素A,B,C的位置如图所示,已知B,C两元素的原子序数之和是A元素原子序数的4倍,则A,B,C依次是( ) A、Be,Na,Al B、C,Al,P C、B,Mg,Si D、O,P,Cl8. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其电子层数的3倍,Y位于周期表IA族,Z是地壳中含量最高的金属,W与X同主族。下列说法错误的是( )A、原子半径: r(Y)>r(Z)>r(W)>r(X) B、X、Y形成的化合物中一定不含共价键 C、X的简单气态氢化物的热稳定性比W的强 D、Y、Z、W的最高价氧化物对应的水化物两两之间均能发生反应9. 已知:aA+、bB2+、cC-、dD2-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是:( )A、原子序数:b>a>c>d B、原子半径:A>B>C>D C、金属性:B>A,非金属性:D>C D、离子半径:D2->C->B2+>A+10. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为 价,Y元素与Z、M元素相邻,且与M元素同主族;化合物 的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法错误的是( )A、原子半径: B、最高价氧化物对应水化物的酸性: C、 易溶于水,其水溶液呈碱性 D、X、Z和Q三种元素形成的化合物一定是共价化合物11. 已知A,B,C,D,E是原子序数依次增大的五种短周期主族元素,其中B和D同主族,中学阶段常见物质X、Y、Z为其中的三种元素组成的化合物,且均为强电解质,当X、Y按物质的量之比为1:2反应时,有如图转化关系。下列说法正确的是( )
A、Be,Na,Al B、C,Al,P C、B,Mg,Si D、O,P,Cl8. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其电子层数的3倍,Y位于周期表IA族,Z是地壳中含量最高的金属,W与X同主族。下列说法错误的是( )A、原子半径: r(Y)>r(Z)>r(W)>r(X) B、X、Y形成的化合物中一定不含共价键 C、X的简单气态氢化物的热稳定性比W的强 D、Y、Z、W的最高价氧化物对应的水化物两两之间均能发生反应9. 已知:aA+、bB2+、cC-、dD2-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是:( )A、原子序数:b>a>c>d B、原子半径:A>B>C>D C、金属性:B>A,非金属性:D>C D、离子半径:D2->C->B2+>A+10. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为 价,Y元素与Z、M元素相邻,且与M元素同主族;化合物 的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法错误的是( )A、原子半径: B、最高价氧化物对应水化物的酸性: C、 易溶于水,其水溶液呈碱性 D、X、Z和Q三种元素形成的化合物一定是共价化合物11. 已知A,B,C,D,E是原子序数依次增大的五种短周期主族元素,其中B和D同主族,中学阶段常见物质X、Y、Z为其中的三种元素组成的化合物,且均为强电解质,当X、Y按物质的量之比为1:2反应时,有如图转化关系。下列说法正确的是( ) A、C,D,E三种元素一定位于同一周期 B、物质X、Y、Z既含有离子键又含有共价键 C、C和D形成的化合物溶于水,其溶液显中性 D、简单氢化物的热稳定性:D>E12. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
A、C,D,E三种元素一定位于同一周期 B、物质X、Y、Z既含有离子键又含有共价键 C、C和D形成的化合物溶于水,其溶液显中性 D、简单氢化物的热稳定性:D>E12. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( ) A、Q位于第三周期ⅠA族 B、X、Y、Z三种元素组成的化合物可能是盐或碱 C、Z与M的最高价氧化物对应水化物均为强酸 D、简单离子半径:M->Q+>R2+
A、Q位于第三周期ⅠA族 B、X、Y、Z三种元素组成的化合物可能是盐或碱 C、Z与M的最高价氧化物对应水化物均为强酸 D、简单离子半径:M->Q+>R2+二、综合题
-
13. A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
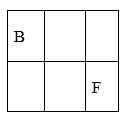 (1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。14. X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
(1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。14. X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)、Y元素在周期表中的位置是;X、Y原子半径的大小:XY(填“>”、“<”或“=”)(2)、X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入(填物质名称);负极电极反应式为。(3)、C在一定条件下反应生成A的化学方程式是。(4)、已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是(填写下列各项的序号)。a.达到化学平衡的过程中,混合气体平均相对分子质量减小
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d. 达到化学平衡时,正反应速率与逆反应速率相等
15. 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题: (1)、①的元素符号是;②的氢化物电子式(2)、②和⑤的原子半径大小关系是②⑤(填“>”“<”或“=”);(3)、③和⑤形成的化合物含有的化学键是(填“离子键”或“共价键”);(4)、③、④的最高价氧化物对应的水化物相互反应的离子方程式为。16. 现有A、B、C、D、E、F、G是元素周期表中前18号元素,它们的原子序数依次增大。A与E同主族且A的原子半径最小;B与D组成常见化合物BD、BD2 , 且二者相对分子质量相差16; F的最外层电子数等于电子层数,G单质是黄绿色气体。(1)、B在元素周期表中的位置是 。(2)、C2的电子式为 , D、E、G对应的简单离子半径由小到大的顺序为 (用离子符号表示)。(3)、写出一个能用于证明元素B、G的非金属性强弱的化学反应方程式 。(4)、化合物甲由D、F两元素组成,将化合物甲、C单质与B单质按物质的量之比1∶1∶3在一定条件下反应可得到乙和BD,写出反应方程式为 。
(1)、①的元素符号是;②的氢化物电子式(2)、②和⑤的原子半径大小关系是②⑤(填“>”“<”或“=”);(3)、③和⑤形成的化合物含有的化学键是(填“离子键”或“共价键”);(4)、③、④的最高价氧化物对应的水化物相互反应的离子方程式为。16. 现有A、B、C、D、E、F、G是元素周期表中前18号元素,它们的原子序数依次增大。A与E同主族且A的原子半径最小;B与D组成常见化合物BD、BD2 , 且二者相对分子质量相差16; F的最外层电子数等于电子层数,G单质是黄绿色气体。(1)、B在元素周期表中的位置是 。(2)、C2的电子式为 , D、E、G对应的简单离子半径由小到大的顺序为 (用离子符号表示)。(3)、写出一个能用于证明元素B、G的非金属性强弱的化学反应方程式 。(4)、化合物甲由D、F两元素组成,将化合物甲、C单质与B单质按物质的量之比1∶1∶3在一定条件下反应可得到乙和BD,写出反应方程式为 。