专题22:溶液的酸碱性
试卷更新日期:2020-10-22 类型:一轮复习
一、单选题
-
1. 下列溶液呈碱性的是( )A、NH4NO3 B、H2SO4 C、KCl D、Na2CO32. 下列说法不正确的是( )A、某溶液c(H+)>c(OH-),则该溶液一定显酸性 B、0.1mol·L-1一元酸HX溶液pH=3,则HX一定为弱电解质 C、相同温度下,等浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大 D、相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-) =c(CH3COO-)3. 常温下,用0.1 mol·L-1 KOH溶液滴定10 mL 0.1 mol·L-1 HA(Ka=1.0×10-5)溶液的滴定曲线如图所示。下列说法错误的是( )
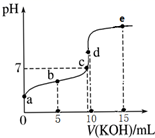 A、a点溶液的pH约为3 B、水的电离程度:d点>c点 C、b点溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-) D、e点溶液中:c(K+)=2c(A-)+2c(HA)4. pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )A、9:1 B、1:11 C、1:9 D、11:15. 25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是( )
A、a点溶液的pH约为3 B、水的电离程度:d点>c点 C、b点溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-) D、e点溶液中:c(K+)=2c(A-)+2c(HA)4. pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )A、9:1 B、1:11 C、1:9 D、11:15. 25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是( )序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A、酸性强弱:H2CO3>HF B、①和②中溶质均未水解 C、①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-) D、④中:c( ) + 2c( ) + c(H2CO3) = 0.1 mol/L6. 常温下,用 氨水滴定 浓度均为 的 和 的混合液,下列说法错误的是( )A、在氨水滴定前, 和 的混合液中 B、当滴入氨水 时, C、当滴入氨水 时, D、当溶液呈中性时,氨水滴入量大于 ,7. 已知电解质溶液电导率越大导电能力越强。常温下用 溶液分别滴定10.00mL浓度均为 的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。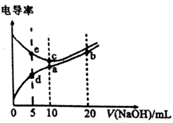 A、c点的混合液pH=7 B、e、d两点溶液混合后的溶液中: C、b点溶液中: D、a、b、c三点溶液中水的电离程度:8. 25℃时,体积均为25.00mL,浓度均为0.0100mo1•L-1的HA、H3B溶液分别用0.0100mo1•L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )
A、c点的混合液pH=7 B、e、d两点溶液混合后的溶液中: C、b点溶液中: D、a、b、c三点溶液中水的电离程度:8. 25℃时,体积均为25.00mL,浓度均为0.0100mo1•L-1的HA、H3B溶液分别用0.0100mo1•L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )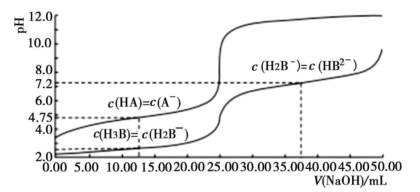 A、25℃时,0.0100mo1•L-1Na2HB溶液的pH>7 B、向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA) C、NaOH溶液滴定HA溶液应选甲基橙作指示剂 D、25℃时,H2B-离子的水解常数的数量级为10-39. 向20mL0.1mol/L的NaHCO3溶液中滴加0.1mol/L氨水(已知室温下H2CO3Ka1=4.2×10-7 , Ka2=5.6x10-11),NH3•H2O(Kb=1.78×10-5),下列说法错误的是( )A、0.1mol/L的NaHCO3溶液中:c(OH-)+c(CO )=c(H2CO3)+c(H+) B、无论滴加多少氨水,溶液中一定满足:c(HCO )+c(CO )+c(H2CO3)=c(Na+) C、当滴入10mL氨水时,发生反应的离子方程式为:HCO +NH3·H2O=CO +NH +H2O,该反应的平衡常数约为0.1 D、当滴入20mL NH3·H2O时,c(Na+)=c(NH )+c(NH3·H2O)=0.1mol/L10. 下列说法中正确的是( )A、c(H+)等于1×10-7mol/L的溶液一定是中性溶液 B、常温下pH=10的氨水中由水电离出来的c(H+)与pH=4的NH4Cl溶液相同 C、pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:②>①>③ D、醋酸和氢氧化钠反应后的溶液,若溶液呈中性,则c(CH3COO-)=c(Na+)11. 常温下,向20mL0.1mol•L﹣1的H2A(二元弱酸)溶液中滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
A、25℃时,0.0100mo1•L-1Na2HB溶液的pH>7 B、向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA) C、NaOH溶液滴定HA溶液应选甲基橙作指示剂 D、25℃时,H2B-离子的水解常数的数量级为10-39. 向20mL0.1mol/L的NaHCO3溶液中滴加0.1mol/L氨水(已知室温下H2CO3Ka1=4.2×10-7 , Ka2=5.6x10-11),NH3•H2O(Kb=1.78×10-5),下列说法错误的是( )A、0.1mol/L的NaHCO3溶液中:c(OH-)+c(CO )=c(H2CO3)+c(H+) B、无论滴加多少氨水,溶液中一定满足:c(HCO )+c(CO )+c(H2CO3)=c(Na+) C、当滴入10mL氨水时,发生反应的离子方程式为:HCO +NH3·H2O=CO +NH +H2O,该反应的平衡常数约为0.1 D、当滴入20mL NH3·H2O时,c(Na+)=c(NH )+c(NH3·H2O)=0.1mol/L10. 下列说法中正确的是( )A、c(H+)等于1×10-7mol/L的溶液一定是中性溶液 B、常温下pH=10的氨水中由水电离出来的c(H+)与pH=4的NH4Cl溶液相同 C、pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:②>①>③ D、醋酸和氢氧化钠反应后的溶液,若溶液呈中性,则c(CH3COO-)=c(Na+)11. 常温下,向20mL0.1mol•L﹣1的H2A(二元弱酸)溶液中滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )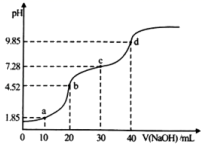 A、a点的溶液中:c(Na+)>c(A2−)>c(HA−)>c(H+)>c(OH−) B、b点的溶液中:c(H2A)+c(H+)=c(A2−)+c(OH−) C、c点溶液的pH>7,是因为此时HA−的电离能力小于其水解能力 D、若将0.1mol•L﹣1的NaOH溶液换成同浓度的氨水,当滴加40mL时,此时溶液的pH>9.8512. 下列说法正确的是( )A、常温下pH=2的HA溶液与pH=12的BOH等体积混合,溶液pH>7,则BOH为强碱 B、在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等 C、稀释1mol・L-1的HCl溶液,溶液中的离子浓度均下降 D、常温下pH=2的CH3COOH溶液和pH=2的H2SO4溶液,c(CH3COO-)=2c(SO42-)
A、a点的溶液中:c(Na+)>c(A2−)>c(HA−)>c(H+)>c(OH−) B、b点的溶液中:c(H2A)+c(H+)=c(A2−)+c(OH−) C、c点溶液的pH>7,是因为此时HA−的电离能力小于其水解能力 D、若将0.1mol•L﹣1的NaOH溶液换成同浓度的氨水,当滴加40mL时,此时溶液的pH>9.8512. 下列说法正确的是( )A、常温下pH=2的HA溶液与pH=12的BOH等体积混合,溶液pH>7,则BOH为强碱 B、在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等 C、稀释1mol・L-1的HCl溶液,溶液中的离子浓度均下降 D、常温下pH=2的CH3COOH溶液和pH=2的H2SO4溶液,c(CH3COO-)=2c(SO42-)二、综合题
-
13. 碳及其化合物在生产和生活中有重要意义。海水中CO2的吸收能力取决于溶解的碳酸盐和硼酸盐生成的CO32-和B(OH)4-浓度。已知:298K时,H3BO3+H2O H++B(OH)4- , Ka=5.7×10-10 , 碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11(1)、298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,pH较大的是溶液。(2)、少量CO2与B(OH)4-反应的离子方程式为。(3)、采用高温熔融混合碳酸盐LiaNabKcCO3作电解质吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径。此法的阴极电极反应式为。14. 氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
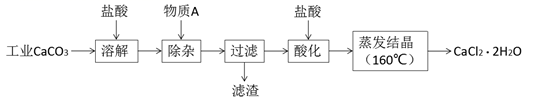
完成下列填空:
(1)、除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+ , 根据下表所给信息,此时控制溶液的pH范围是 , 加入的物质A是(写化学式)。开始沉淀时的pH
沉淀完全时的pH
沉淀开始溶解时的pH
Al(OH)3
3.3
5.2
7.8
Fe(OH)3
1.5
4.1
-
(2)、检验Fe3+是否沉淀完全的实验操作是。(3)、酸化操作是加入盐酸,调节溶液的pH,其目的是。(4)、测定制得的样品的纯度,可采用如下方案:a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有。
②计算上述样品中CaCl2·2H2O的质量分数为(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况。
15. 水是生命之源,万物之基。不仅如此,水在化学中的作用也不可忽视。(1)、I.常温下,浓度均为0.1 mol·L-1的下列五种水溶液的pH如下表:
上述盐溶液中的阴离子,结合质子能力最强的是。
(2)、根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最弱的是;将各溶液分别加水稀释100倍,pH变化最大的是(填字母)。A.HCN B.HClO C.H2CO3 D.CH3COOH
(3)、要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为。(4)、II.已知水在25℃和95℃时,其电离平衡曲线如图所示: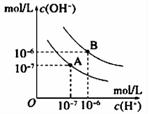
95℃时水的电离平衡曲线应为(选填“A”或“B”);
(5)、25℃时,将pH=10的NaOH溶液与pH=6的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为;(6)、95℃时,若1体积pH=a的某强酸溶液与10x体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是。16. 在室温下,下列四种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水。请根据要求填写下列空白:(1)、溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)。(2)、室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)。(3)、常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。A、c(H+) B、 C、c(H+)·c(OH-) D、 E、(4)、25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为。