专题20:化学键
试卷更新日期:2020-10-22 类型:一轮复习
一、单选题
-
1. 已知下表中几种物质的熔、沸点:
熔点/℃
801
730
190
1040
沸点/℃
1413
1380
180
1537
据此判断,下列说法错误的是( )
A、 和 熔融时通电,会发生化学变化 B、 晶体中存在分子间作用力 C、 晶体中的化学键是离子键 D、 晶体为离子晶体2. 下列物质属于共价化合物的是( )A、N2 B、C2H5OH C、NH4Cl D、Na2CO33. 有共价键的离子化合物是( )A、NaOH B、H2SO4 C、CH2Cl2 D、AlCl34. 金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能。据此,试判断在100kPa压强下,下列结论正确的是( )A、石墨比金刚石稳定 B、金刚石比石墨稳定 C、1mol石墨比1mol金刚石的总能量高 D、1mol石墨和1mol金刚石的总能量相等5. 下列各组物质的晶体中,化学键种类相同,晶体类型也相同的是( )A、SO2与SiO2 B、CCl4与CaCl2 C、NaBr与HCl D、CO2与H2O6. 下列各组物质均既有离子键又有共价键的是( )A、KOH、H2SO4、NH4Cl B、CaO、Na2CO3、NH4HCO3 C、HClO、Al2O3、MgCl2 D、K2O2、NaOH、K2SO47. 下列说法正确的是:( )A、π键是由两个p电子“头碰头”重叠形成的 B、σ键是镜面对称,而π键是轴对称 C、乙烷分子中的键全为σ键,乙烯分子中含σ键和π键 D、H2分子中含σ键,Cl2分子中含π键8. B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )A、其熔点主要取决于所含化学键的键能 B、形成大π键的电子全部由N提供 C、分子中B和N的杂化方式相同 D、分子中所有原子共平面9. H2 和 I2 在一定条件下能发生反应:H2(g) +I2(g) 2HI(g) △H= -a kJ/mol已知:
 (a、b、c 均大于零)
(a、b、c 均大于零)下列说法正确的是( )
A、碰撞理论认为,反应速率的大小与单位时间内反应物微粒间碰撞次数成正比,只要有足够的能量就可以发生有效碰撞 B、断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ C、相同条件下,1 mol H2 (g)和 1mol I2 (g)总能量小于 2 mol HI (g)的总能量 D、向密闭容器中加入 2 mol H2 (g)和 2 mol I2 (g),充分反应后放出的热量为 2a kJ10. 下列说法正确的个数为( )①化学键断裂,一定发生化学变化
②任何物质中都存在化学键
③氢键是极弱的化学键
④离子键就是阴、阳离子之间的静电吸引力
⑤活泼金属与活泼非金属化合时能形成离子键
⑥任何共价键中,成键原子成键后均满足稳定结构
⑦验证化合物是否为离子化合物的实验方法是可以看其熔化状态下能否导电
⑧两种非金属元素形成的化合物不可能含有离子键
A、1 B、2 C、3 D、4二、综合题
-
11. 现有下列物质:
①N2②Na2O2③MgF2④NH4Cl⑤Na2CO3⑥NaOH⑦HCl⑧H2O2
(1)、属于离子化合物的物质是。(2)、属于共价化合物的物质是。(3)、只由非极性键构成的物质是。(4)、由离子键和极性键构成的物质是。(5)、由极性键和非极性键构成的物质是。12.(1)、气态氢化物热稳定性 大于 的主要原因是。(2)、 是离子化合物,各原子均满足8电子稳定结构, 的电子式是。(3)、常温下,在水中的溶解度乙醇大于氯乙烷,原因是。13.(1)、比较电离出H+能力的相对强弱:HCO C6H5OH(填“>” 、“<”或“=”);用一个化学方程式说明上述强弱关系。(2)、CaC2是离子化合物,各原子均满足8电子稳定结构。写出CaC2的电子式。(3)、根据氨水的性质,判断下图中氢键表示正确的是_________。A、 B、
B、 14. A、B、C、D四种常见元素的结构信息如下表。试根据信息回答有关问题。
14. A、B、C、D四种常见元素的结构信息如下表。试根据信息回答有关问题。元素
A
B
C
D
性质结构信息
最常见氢化物X为三角锥分子且能与 HCl发生化合反应生成盐
原子的 M 层上电子数比L层电子数少2个
ds区元素,N 层上有一个电子
原子的s电子数是p电子数的2倍
(1)、写出基态B原子的电子排布式:。(2)、向CSO4的溶液中逐滴加入过量X的水溶液,可生成的配合物的化学式为 , 该物质中不存在的作用类型为(填字母)。a.离子键 b.配位键 c.极性键 d.氢键
(3)、下列几种氢化物分子:① AH3 ②D2H2③H2B ④DH4
中心原子采用sp3杂化形成化学键的是 (填序号);在②的分子中有 个σ键,该分子中电子运动状态共有 种。
15. 根据要求完成下列问题:(1)、某元素原子共有 3 个价电子,其中一个价电子位于第三能层 d 轨道,试回答: 该元素核外价电子排布图为 , 电子排布式为。 该元素的原子序数为 , 该元素是元素(填“金属”或“非金属”),形成的单质为晶体。(2)、指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、。(3)、下列分子中若有手性原子,请用“*”标出其手性碳原子、。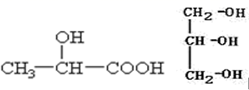 (4)、在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填编号)。(5)、试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4H2SO3;HClO3HClO4;(6)、根据价层电子对互斥理论判断下列问题:H2S 中心原子的杂化方式为杂化,VSEPR 构型为 , 分子的立体构型为。(7)、H2O 的沸点(100℃)比 H2S 的沸点(-61℃)高,这是由于。16. 磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
(4)、在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填编号)。(5)、试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4H2SO3;HClO3HClO4;(6)、根据价层电子对互斥理论判断下列问题:H2S 中心原子的杂化方式为杂化,VSEPR 构型为 , 分子的立体构型为。(7)、H2O 的沸点(100℃)比 H2S 的沸点(-61℃)高,这是由于。16. 磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)、磷原子的核外电子排布式:;磷原子核外有种能量不同的电子。(2)、上述反应的反应物和生成物中含有非极性键的分子是。(写出物质的化学式)(3)、将Na、O、P三种原子的原子半径大小按由大到小的顺序排列。(4)、NH3的稳定性比PH3的(填“强”或“弱”) , 判断理由是。(5)、A、配平上述反应,并标出电子转移方向与数目P4+ NaOH+H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为。