初中科学浙教版八年级上册期中复习05:物质的溶解
试卷更新日期:2020-10-21 类型:复习试卷
一、物质的溶解性
-
1. 如图是模拟海水晒盐过程的示意图,与丙烧杯溶液的溶质质量分数一定相同的是( )
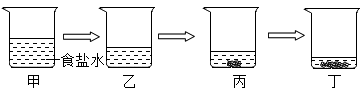 A、甲和乙 B、乙 C、甲和丁 D、丁2. 现有一杯硝酸钾饱和溶液,欲改变其溶质质量分数,下列方法可行的是( )A、加入一定量硝酸钾 B、升温到60℃ C、加入一定量水 D、恒温蒸发部分水3. 30℃时将等质量的两份饱和石灰水一份冷却到20℃,另一份加入少量生石灰,温度仍保持在30℃。则两种情况下均不改变的是( )A、 溶剂的质量 B、溶质的质量 C、溶质的溶解度 D、溶液中溶质的质量分数4. 在其他条件不改变的情况下,对下列四种溶液作对应的处理,最终所得溶液的溶质质量分数一定变大的是( )A、
A、甲和乙 B、乙 C、甲和丁 D、丁2. 现有一杯硝酸钾饱和溶液,欲改变其溶质质量分数,下列方法可行的是( )A、加入一定量硝酸钾 B、升温到60℃ C、加入一定量水 D、恒温蒸发部分水3. 30℃时将等质量的两份饱和石灰水一份冷却到20℃,另一份加入少量生石灰,温度仍保持在30℃。则两种情况下均不改变的是( )A、 溶剂的质量 B、溶质的质量 C、溶质的溶解度 D、溶液中溶质的质量分数4. 在其他条件不改变的情况下,对下列四种溶液作对应的处理,最终所得溶液的溶质质量分数一定变大的是( )A、 B、
B、 C、
C、 D、
D、
二、饱和溶液与不饱和溶液
-
5. 下列有关饱和溶液的说法错误的是( )A、饱和溶液不一定是浓溶液 B、饱和溶液一定不能再溶解任何溶质 C、饱和溶液降低温度后不一定会析出晶体 D、饱和溶液析出晶体后,溶质质量分数可能改变6. 甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析正确的是( )
 A、甲可能是不饱和溶液,丙和丁一定是饱和溶液 B、丙的溶液质量和乙的相同 C、在甲→丙的过程中,蔗糖的溶解度先增大后减小 D、乙的溶质质量分数比甲大7. 冷却热饱和溶液常用来提纯一些物质,在烧杯中冷却热饱和溶液析出晶体过程中,剩余溶液跟冷却前溶液相比(不考虑水的蒸发)( )A、变为不饱和溶液 B、溶质质量不变 C、溶质的质量分数减小 D、还是饱和溶液,溶质的质量分数不变8. 某溶液恒温蒸发掉部分溶剂后,无晶体析出,下列说法正确的是( )A、原溶液可能是饱和溶液 B、剩余的溶液一定是不饱和溶液 C、剩余的溶液可能是饱和溶液 D、剩余的溶液与原溶液中溶质的质量分数可能相等
A、甲可能是不饱和溶液,丙和丁一定是饱和溶液 B、丙的溶液质量和乙的相同 C、在甲→丙的过程中,蔗糖的溶解度先增大后减小 D、乙的溶质质量分数比甲大7. 冷却热饱和溶液常用来提纯一些物质,在烧杯中冷却热饱和溶液析出晶体过程中,剩余溶液跟冷却前溶液相比(不考虑水的蒸发)( )A、变为不饱和溶液 B、溶质质量不变 C、溶质的质量分数减小 D、还是饱和溶液,溶质的质量分数不变8. 某溶液恒温蒸发掉部分溶剂后,无晶体析出,下列说法正确的是( )A、原溶液可能是饱和溶液 B、剩余的溶液一定是不饱和溶液 C、剩余的溶液可能是饱和溶液 D、剩余的溶液与原溶液中溶质的质量分数可能相等三、物质的溶解度
-
9. 30℃时,将一定量的硝酸钾投入盛有100克水的烧杯中,充分溶解后烧杯底部仍有部分固体,以下操作中能通过改变硝酸钾溶解度而使固体溶解的是( )A、 加入一定量的水 B、降低温度 C、升高温度 D、用玻璃棒充分搅拌10. 一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )
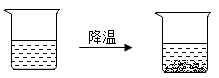 A、溶液质量不变 B、溶液的溶质质量分数变小 C、硝酸钾的溶解度变大 D、原溶液一定是饱和溶液11. 20℃时,氯化钠(NaCl)溶解于水的实验数据如表所示,则下列叙述正确的是( )
A、溶液质量不变 B、溶液的溶质质量分数变小 C、硝酸钾的溶解度变大 D、原溶液一定是饱和溶液11. 20℃时,氯化钠(NaCl)溶解于水的实验数据如表所示,则下列叙述正确的是( )实验序号
水的质量(一)
加入NaCl的质量(g)
溶液的质量(g)
①
10
2
12
②
10
3
13
③
10
4
13.6
④
10
5
13.6
A、 ①所得溶液的溶质质量分数为20% B、②所得溶液是饱和溶液 C、20"C时,氯化钠的溶解度是36g/100g水 D、③④溶液的溶质质量分数不相等12. 某物质在20℃时的溶解度为20g/100g水,在20℃时将20g该物质投入到80g水中充分溶解,则该物质溶液中溶质质量分数为( )A、25% B、20% C、16.7% D、无法计算13. 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示。下列判断正确的是( )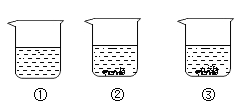 A、①中所得溶液一定是不饱和溶液 B、②③中所得溶液溶质的质量分数相等 C、若②中溶液升温到30℃,溶液的质量一定不变 D、若③中溶液恒温蒸发,溶质的质量分数一定变大14. 某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )A、变大 不变 B、变大 变小 C、不变 变大 D、不变 不变15. t1℃时,将a、b两种固体物质(均不含结晶水)各15g,分别加入盛有100g水的烧杯中,充分搅拌后,现象如图甲所示;降温到t2℃时,忽略水分蒸发,现象如图乙所示。下列说法正确的是( )
A、①中所得溶液一定是不饱和溶液 B、②③中所得溶液溶质的质量分数相等 C、若②中溶液升温到30℃,溶液的质量一定不变 D、若③中溶液恒温蒸发,溶质的质量分数一定变大14. 某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )A、变大 不变 B、变大 变小 C、不变 变大 D、不变 不变15. t1℃时,将a、b两种固体物质(均不含结晶水)各15g,分别加入盛有100g水的烧杯中,充分搅拌后,现象如图甲所示;降温到t2℃时,忽略水分蒸发,现象如图乙所示。下列说法正确的是( ) A、t1℃时a、b溶液均为不饱和溶液 B、t2℃时a、b溶液均为饱和溶液 C、t1℃时a、b的溶解度相同 D、t2℃时a、b的溶解度相同16. 生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )A、烧开水时,沸腾前有气泡溢出 B、喝下汽水感到有气体冲到鼻腔 C、拧开汽水瓶盖,有大量气泡溢出 D、阳光充足时,盛满水的鱼缸壁上有气泡17. 温度不变的条件下,将100克A物质溶液蒸发掉10克水,有4克晶体析出,再蒸发掉10克水,又有5克晶体析出。则A物质在该温度下的溶解度为克,若再恒温蒸发10克水,有克晶体析出。18. 下列为氯化钠和氯化铵在不同温度时的溶解度。回答下列问题:
A、t1℃时a、b溶液均为不饱和溶液 B、t2℃时a、b溶液均为饱和溶液 C、t1℃时a、b的溶解度相同 D、t2℃时a、b的溶解度相同16. 生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )A、烧开水时,沸腾前有气泡溢出 B、喝下汽水感到有气体冲到鼻腔 C、拧开汽水瓶盖,有大量气泡溢出 D、阳光充足时,盛满水的鱼缸壁上有气泡17. 温度不变的条件下,将100克A物质溶液蒸发掉10克水,有4克晶体析出,再蒸发掉10克水,又有5克晶体析出。则A物质在该温度下的溶解度为克,若再恒温蒸发10克水,有克晶体析出。18. 下列为氯化钠和氯化铵在不同温度时的溶解度。回答下列问题:温度/℃
0
10
20
30
40
50
氯化铵溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
氯化钠溶解度/g
35.7
35.8
36.0
36.3
36.6
37.0
(1)、分析表中数据可得出的结论有。(一条即可)(2)、20℃时,若在50克水中放入40克氯化钠,充分溶解后所得溶液的溶质质量分数是。(3)、将50℃的含有200克水的氯化铵饱和溶液降温至20℃,析出氯化铵晶体的质量是克。19. 下表是A、B、C三种固体物质在不同温度下(t1<t2<t3)的溶解度,请回答:温度(℃)
t1
t2
t3
物质A(克)
36.0
36.2
37.3
物质B(克)
31.6
36.2
110.0
物质C(克)
0.165
0.135
0.076
(1)、 ℃时,A、B两种物质的溶解度相同。(2)、t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为(选填“甲”或“乙”)。 (3)、t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为。20. 氢氧化钙在在20℃的溶解度为0.165克,表示.
(3)、t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为。20. 氢氧化钙在在20℃的溶解度为0.165克,表示.四、溶液的配制
-
21. 在配制50g溶质质量分数为 10%的氯化钠溶液操作过程中,下列操作与目的分析都正确的是( )
选项
操作
目的
A
用剩的食盐放回原试剂瓶
避免浪费
B
天平调平后在左、右托盘各垫一张相同的纸
保证称取的食盐质量更准确
C
用50mL量筒替代天平来量取所需的水
更加简便
D
溶解时用玻璃棒搅拌
增强食盐的溶解能力
A、A B、B C、C D、D22. 配制70克16%的NaCl溶液,下列操作会使所配溶液溶质质量分数大于16%的是( )A、称取氯化钠 B、转移氯化钠
B、转移氯化钠  C、量取水
C、量取水  D、配好后装瓶
D、配好后装瓶  23. 现有100g10%的硝酸钠溶液,要使其溶质质量分数增大一倍,采取了以下方法
23. 现有100g10%的硝酸钠溶液,要使其溶质质量分数增大一倍,采取了以下方法①再加入10g硝酸钠
②蒸发掉一半溶剂
③蒸发掉50g水
④再加入100g10%的该溶液
⑤与100g30%的该物质溶液混合。其中正确的有( )
A、1个 B、2个 C、3个 D、4个24. 今有60g溶质的质量分数为10%的食盐溶液,欲将其溶质的质量分数增大一倍,应采用的方法是( )A、把溶剂蒸发掉一半 B、加入6g食盐晶体 C、把溶剂蒸发掉30g D、加入20%的食盐溶液30g25. 实验室需配制一定质量分数的硝酸钾溶液:(1)、查阅硝酸钾的溶解度。已知,20℃时,硝酸钾的溶解度为31.6g,在该温度下配制硝酸钾溶液,溶质的质量分数最大为 %(计算结果保留整数)。(2)、计算。配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为 g,所需蒸馏水的体积为mL(1mL水的质量是1g)。(3)、称量。分别在天平左右两盘放上纸片,调节平衡后, (填字母)。A、先移动游码到所需位置,再添加硝酸钾直到天平平衡 B、先添加所需的硝酸钾, 再移动游码直到天平平衡(4)、量取。量取所需蒸馏水要用到的仪器是(填字母)。量取时,若俯视刻度线,则实际所配制溶液中溶质的质量分数偏 。
溶解。将称量好的硝酸钾和蒸馏水混合溶解。
26. 如图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
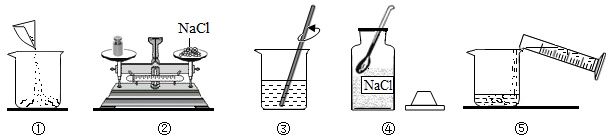 (1)、如图中的玻璃仪器分别是广口瓶、量筒、和玻璃棒,其中玻璃棒在此操作中的作用是。(2)、指出图②中的一处错误操作。(3)、通过计算确定需要水的质量是g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。量水时,量筒必须平放,视线要跟量筒中水的凹液面的处保持水平。(4)、用上述图示的序号表示配制溶液的操作顺序 。27. 如图是配制50克质量分数为5%的氯化钠溶液的操作过程示意图
(1)、如图中的玻璃仪器分别是广口瓶、量筒、和玻璃棒,其中玻璃棒在此操作中的作用是。(2)、指出图②中的一处错误操作。(3)、通过计算确定需要水的质量是g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。量水时,量筒必须平放,视线要跟量筒中水的凹液面的处保持水平。(4)、用上述图示的序号表示配制溶液的操作顺序 。27. 如图是配制50克质量分数为5%的氯化钠溶液的操作过程示意图 (1)、B操作,在称量中发现指针偏向右边,接下来的操作是;(2)、E操作中玻璃棒的作用是。(3)、如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏大的是 。A、所用氯化钠药品不纯 B、量取水时俯视读数 C、配完后将溶液转移至试剂瓶时洒出了一些 D、将量好的水从量筒里倒入烧杯时,酒出一些水
(1)、B操作,在称量中发现指针偏向右边,接下来的操作是;(2)、E操作中玻璃棒的作用是。(3)、如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏大的是 。A、所用氯化钠药品不纯 B、量取水时俯视读数 C、配完后将溶液转移至试剂瓶时洒出了一些 D、将量好的水从量筒里倒入烧杯时,酒出一些水